Запишем кинетическое условие равновесия:
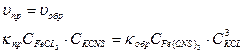
Отсюда выведем выражение константы равновесия (Kc)
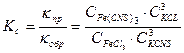
Константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации, давления и наличия катализатора.
Смещение химического равновесия объясняется неодинаковым изменением 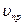 и
и 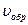 вследствие изменения одного из условий (C,P,t°), при этом:
вследствие изменения одного из условий (C,P,t°), при этом:
если 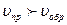 , то равновесие смещается “ → ”
, то равновесие смещается “ → ”
если 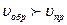 , то равновесие смещается “ ← ”
, то равновесие смещается “ ← ”
В ходе опыта в первых двух случаях мы увеличивали концентрацию исходных веществ, и равновесие смещалось в сторону продуктов реакцию
В третьем случае мы увеличили концентрацию одного из продуктов реакции (KCL), и равновесие смещалось в сторону исходных веществ.
Результаты опыта подтверждают принцип Ле Шателье: большое количество исходных веществ/продуктов реакции сместило равновесие в сторону продуктов реакции/исходных веществ, чем уменьшило воздействие большего количества исходных веществ/продуктов реакции.
5. Название опыта: Влияние температуры на состояние равновесия
|
|
|
5.1. Ход и данные опыта
Условие проведения опыта: При взаимодействии иода с крахмалом образуется вещество сложного состава – иодокрахмал, синего цвета. Реакцию можно представить в виде
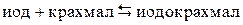
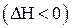 .
.
Изменение интенсивности синего окрашивания иодокрахмала позволяет следить за сдвигом химического равновесия при изменении температуры.
Порядок выполнения опыта: В пробирку нальем 4 –5 мл раствора крахмала и добавим несколько капель 0,1 н раствора I2 до появления синего окрашивания. Разделим содержимое пробирки на две. Нагрейте одну пробирку с раствором, поместив её в стакан с горячей водой. Затем охладите её до комнатной температуры (под проточной водой), наблюдая в обоих случаях за изменением окраски растворов и сравнивая её с контрольной.
 2015-05-10
2015-05-10 211
211








