Выделение газа закончилось быстрее в пробирке с мелом.
Запишем уравнение реакции взаимодействия мела и мрамора с соленой кислотой, учитывая, что мел и мрамор имеют одинаковую химическую формулу: 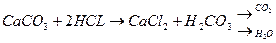
Запишем выражение ЗДМ для каждой реакции:
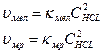
Т.к. в реакции с мелом поверхность соприкосновения больше (мел -пористое вещество) то вероятность соударения частиц больше, т.е. реакционная способность мела в данном случае выше => 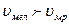
Вывод
В течение времени проведения опыта убедились, что реакция проходит быстрее между теми веществами, S поверхность соприкосновения которых больше.
4. Название опыта: Влияние концентрации реагирующих веществ
на состояние равновесия
4.1. Ход и данные опыта
Условие проведения опыта: Исследуем при постоянной температуре на примере реакции взаимодействия хлорного железа (FeCl3) с роданидом калия (KCNS):
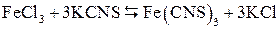 .
.
Красное окрашивание роданида железа Fe(CNS)3 позволяет следить за сдвигом химического равновесия при изменении концентрации реагирующих веществ.
Порядок выполнения опыта: Нальём в химический стакан 5 мл 0,01 н раствора FeCl3 и добавьте 5 мл 0,01 н раствора KCNS (или NH4CNS). Полученный раствор разольём на 4 пробирки. В первую пробирку добавим 3–5 капель концентрированного раствора FeCl3, во вторую – 2–3 капли концентрированного раствора KCNS, в третью поместите немного твердого KCl (или NH4Cl), встряхнем пробирку, чтобы ускорить растворение соли. Сравним интенсивность окраски полученных растворов с цветом раствора в контрольной пробирке. Результаты наблюдений запишите в табл. 3
| Таблица 3 | |||
| Номер пробирки | Добавленное вещество | Изменение интенсивности окраски (ослаблениe, усиление) | Направление смещения равновесия 
|
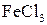
| Усиление (светло-коричневый цвет) | → | |
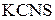
| Усиление (бурый цвет) | → | |
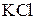
| Ослабление (желтый цвет) | ← | |
| Контрольная | Оранжевый цвет | → ← |
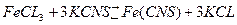
 2015-05-10
2015-05-10 279
279








