ЛАБОРАТОРНАЯ РАБОТА № 3
Тема: ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ ЭЛЕКТРОПРОВОДНОСТИ ПРИ БЕСКОНЕЧНОМ РАЗБАВЛЕНИИ СИЛЬНОГО ЭЛЕКТРОЛИТА.
Литература: Лекция №6; [1]: С. 283-300.
Цель: приобретение навыков измерения электропроводности раствора при помощи цифрового кондуктометра, определение молярной электропроводности при бесконечном разбавлении сильного электролита кондуктометрическим методом.
Реактивы и оборудование:
Кондуктометр цифровой с электродом, раствор NaCl0,1 моль/л; вода дистиллированная, бюретка объемом 50 мл, воронка, стакан объемом 50 мл (под бюретку), пронумерованные мерные колбы объемом 100 мл с пробкой — 5 штук, высокий стакан объемом 150 мл для измерений электропроводности.
Теоретические основы
Электропроводность растворов электролитов, то есть способность проводить электрический ток, обусловлена направленным движением ионов под воздействием электрического поля. В проводниках первого рода (металлах) заряд переносится электронами. Растворы электролитов – проводники второго рода, носителями электричества в них служат анионы и катионы. Электропроводность раствора электролита зависит от природы электролита и растворителя, концентрации, температуры и некоторых других факторов.
|
|
|
Удельная электропроводность раствора электролита – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими единичную площадь и удаленными друг от друга на расстояние, равное единице длины. Единицы измерения удельной электрической проводимости c в СИ [Ом–1∙м– 1] или [См∙м–1]; на практике также используют внесистемные единицы [Ом–1∙см–1] или [См∙см–1].
Сложный характер зависимости c от C требует использования других количественных способов выражения электропроводности. В электрохимии наряду с удельной электропроводностью χ используют величину молярной электропроводности l, равную электрической проводимости такого объема раствора, который содержит 1 моль растворенного вещества, при условии, что раствор заключен между двумя параллельными электродами, удаленными друг от друга на расстояние, равное единице длины. В единицах СИ молярная электропроводность λ имеет размерность [Ом−1∙м2∙моль−1] =[См∙м2∙моль−1]. На практике концентрацию раствора часто выражают не в [моль/м3], а в [моль/л], а χ − во внесистемных единицах [Ом−1∙см−1] = [См∙см−1], поэтому при вычислениях следует внимательно относиться к размерности λ в зависимости от используемых единиц c и С.
Молярная электрическая проводимость тоже зависит от концентрации раствора.С увеличением концентрации молярная электрическая проводимость λ уменьшается в растворах сильных и для слабых электролитов вследствие возрастания взаимного влияния ионов или изменения степени диссоциации с разбавлением.
|
|
|
Для сравнения электропроводности электролитов используют значение молярной электропроводности бесконечно разбавленного раствора l¥, то есть раствора такой концентрации, когда взаимным влиянием ионов можно пренебречь, именно эти значения приводятся в справочных таблицах для характеристики электропроводности электролита.
Прямое определение l¥ невозможно,поскольку нельзя на практике приготовить «бесконечно разбавленный раствор». Найти l¥ из графической зависимости l от С (при бесконечном разбавлении С → 0, значение λ максимально) также довольно сложно из-за практических трудностей экстраполяции кривой к оси ординат. Экстраполяция упрощается, если зависимость будет иметь линейный характер.

Рис. 6. Зависимость молярной электрической проводимости растворов сильных электролитов от концентрации
Эмпирически линейная зависимость зависимости l от С обнаружена немецким физиком Кольраушем и известна как «закон квадратного корня»:
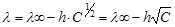 .
.
В координатах l − 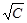 это уравнение выражается прямой, отсекающей на оси ординат отрезок, равный l¥. Постоянная h, зависящая от природы растворителя и электролита, может быть найдена из тангенса угла наклона прямой. Это уравнение используется для экспериментального определения l¥ сильных электролитов в области невысоких концентраций.
это уравнение выражается прямой, отсекающей на оси ординат отрезок, равный l¥. Постоянная h, зависящая от природы растворителя и электролита, может быть найдена из тангенса угла наклона прямой. Это уравнение используется для экспериментального определения l¥ сильных электролитов в области невысоких концентраций.
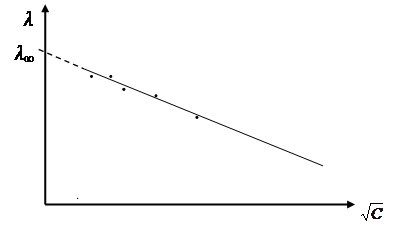
Рис. 7. Зависимость молярной электрической проводимости растворов сильных электролитов от  .
.
 2015-05-10
2015-05-10 439
439







