Металлы растворяются в кислотах в соответствии с их положением в ряду напряжений. Чем выше окислительная активность кислоты, тем больше металлов может быть ею окислено.
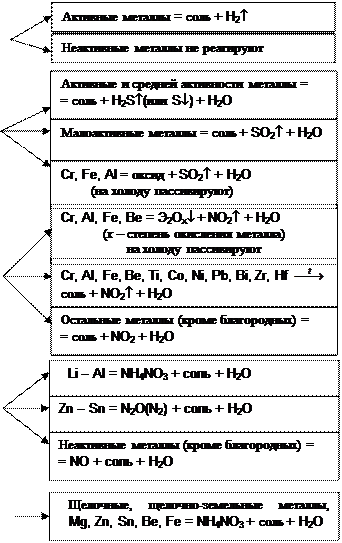 |
HCIразб, H2SO4разб,
HCIконц
окислитель H+
H2SO4конц.
окислитель S+6
HNO3конц
окислитель N+5
HNO3разб
окислитель N+5
HNO3 оч. разб
окислитель N+5
Вопросы для самоподготовки
1. Как строится ряд напряжений металлов? Увеличится, уменьшится или останется без изменений масса цинковой пластинки при взаимодействии ее с растворами солей CuSO4, MgSO4, Pb(NO3)2?Почему?
2. При какой концентрации ионов Zп+2(моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
3. В чем сущность химической (газовой) коррозии металлов? Марганцевый электрод в растворе соли MnSO4 имеет потенциал –1,23 В. Вычислите концентрацию ионов Mn+2 в моль/л.
4. Серебро не вытесняет водород из разбавленных кислот, (почему?). Если к серебру прикоснуться цинковой палочкой, то на нем начнется бурное выделение водорода. Почему? Дайте мотивированный ответ и подтвердите его уравнениями реакций.
|
|
|
5. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух серебряных электродов, один из которых опущен в 0,01 н., а другой в 0,1 н. раствор AgNO3.
6. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы солей с концентрациями [Pb+2] = [Mg+2] - 0,01 моль/л.
7. Чему равен потенциал водородного электрода при: а) рН 10; б) pH 3? Вычислите ЭДС концентрационного гальванического элемента, состоящего из двух водородных электродов, погруженных в растворы кислот с рН 2 и рН 4.
ТЕСТЫ
1.В гальваническом элементе электроны движутся:
а) от катода к аноду;
б) от анода к катоду;
в) движения электронов нет;
г) от аниона к катиону.
2. Значение электродного потенциала меди, погруженной в 0,0002 н. раствор Cu(NO3)2 составляет:
а) –0,22 В;
б) +0,25 В;
в) -0,63 В;
г) +1,2 В.
3. На сколько граммов уменьшится масса CuSO4 в растворе, после того как 1,2 г железа опущенного в раствор полностью прореагирует:
а) 1,2 г;
б) 0,6 г;
в) 2,4 г;
г) 3,4 г.
4. Определите электродвижущую силу гальванического элемента, состоящего из цинковой и алюминиевой пластин, погруженных в растворы их солей, если ΔG элемента равно -283 кДж:
а) 1,62 В;
б) 1,46 В;
в) 0,71 В;
г) 0,83 В.
5. Электроды погружены в 0,2 н. растворы солей. Вычислите ЭДС гальванического элемента (-)Fe/Fe(NO3)2//АgNO3/Аg(+):
а) 1,23 В;
б) 0,86 В;
в) 1,36 В;
г) 0,72 В.
 2015-05-13
2015-05-13 1855
1855








