«В настоящий момент мы знаем, что движение происходит постоянно и что только его размах или направление, или и то и другое вместе, должны видоизменяться для пользы растения соответственно внутренним и внешним стимулам».
Ч. Дарвин
 Движение — это перемещение организма или его частей в пространстве. Способность к активному движению, т. е. к движению с затратой метаболической энергии,— характерное свойство всех живых организмов. Двигательная активность как животных, так и растений необходима для питания, защиты и размножения. У большинства растений движения не удается наблюдать непосредственно, так как они происходят очень медленно. Круговые движения (нутации) совершают верхушки побегов и корней проростков, побеги и листовые пластинки поворачиваются к свету (тропизмы), при смене дня и ночи открываются и закрываются цветки (настии) и т. д. В ускоренном темпе все это можно наблюдать, используя технику цейтрафер-ной съемки. Некоторые растения обладают быстрыми двигательными реакциями, сходными по скорости с движениями животных (мимоза стыдливая, мухоловка, тычинки василька и барбариса и др.). Близки по скоростям у растений и животных внутриклеточные движения (цитоплазмы и органоидов), а также локомоторные движения одноклеточных (таксисы) с помощью жгутиков или ресничек.
Движение — это перемещение организма или его частей в пространстве. Способность к активному движению, т. е. к движению с затратой метаболической энергии,— характерное свойство всех живых организмов. Двигательная активность как животных, так и растений необходима для питания, защиты и размножения. У большинства растений движения не удается наблюдать непосредственно, так как они происходят очень медленно. Круговые движения (нутации) совершают верхушки побегов и корней проростков, побеги и листовые пластинки поворачиваются к свету (тропизмы), при смене дня и ночи открываются и закрываются цветки (настии) и т. д. В ускоренном темпе все это можно наблюдать, используя технику цейтрафер-ной съемки. Некоторые растения обладают быстрыми двигательными реакциями, сходными по скорости с движениями животных (мимоза стыдливая, мухоловка, тычинки василька и барбариса и др.). Близки по скоростям у растений и животных внутриклеточные движения (цитоплазмы и органоидов), а также локомоторные движения одноклеточных (таксисы) с помощью жгутиков или ресничек.
В некоторых случаях продвижение в пространстве у растений достигается за счет верхушечного роста (гифы грибов, пыльцевые трубки, корневые волоски). С использованием изменений тургорного давления в клетках осуществляются движения устьиц, медленные настические движения листьев или быстрые движения листьев в ответ на сотрясение (сейсмонастии). Однако для подавляющего большинства растений, начиная с нитчатых водорослей, характерным способом перемещения в пространстве является рост растяжением. В основе движения растений лежат осмотические процессы в отличие от движений животных, происходящих с участием сократительных белков.
 Способы движения растений можно классифицировать следующим образом:
Способы движения растений можно классифицировать следующим образом:
I. Движение цитоплазмы и органоидов.
II. Локомоторные движения с помощью жгутиков (таксисы).
III. Верхушечный рост (корневые волоски, пыльцевые трубки, протонема мха).
IV. Ростовые движения (удлинение осевых органов, круговые нутации, тропизмы: фото-, гео-, тигмо-, хемо-, термо-и т. д., ростовые настии: фото-, термо-, гигро-).
V. Тургорные движения (движения устьиц, медленные тур-горные движения — настии, быстрые тургорные движения — сейсмонастии).
К этому перечню можно добавить пассивные механические движения растений, такие, как растрескивание спорангиев, сухих плодов и т. д. Распространен у растений пассивный способ переноса пыльцы и семян с помощью ветра и представителей животного мира. Для этой цели в процессе эволюции возникли многочисленные приспособления.
Очевидно, что лишь две первые группы локомоторных движений являются общими для растительных и животных клеток. Движение цитоплазмы и движения с помощью жгутиков осуществляются с участием сократительных белковых систем и относятся к немышечным формам подвижности. Остальные типы движений свойственны только растениям.
Цитоплазма в растительных клетках находится в постоянном движении. На внешние и внутренние воздействия клетки отвечают изменением скорости этого движения. Выделяют несколько типов движения цитоплазмы: колебательное (без упорядоченного перемещения клеточных компонентов, например у спирогиры), циркуляционное (у клеток тычиночных нитей традесканции и других видов с протоплазматическими тяжами, пересекающими вакуоль), ротационное (в клетках с большой центральной вакуолью, например в междоузлиях харовых водорослей), фонтанирующее (у клеток с верхушечным ростом, например, у корневых волосков), по типу прилива (в гифах грибов движение происходит рывками по направлению к растущему кончику гифы).
Наиболее тщательно изучено ротационное движение цитоплазмы в клетках междоузлий харовых водорослей. Движение в этих клетках осуществляется вдоль стенок подобно приводному ремню. Слой цитоплазмы, примыкающий к плазмалемме (кортикальный слой, эктоплазма), практически неподвижен. Вдоль его внутренней поверхности скользит подвижный слой цитоплазмы — эндоплазма.
В цитоплазме клеток растений обнаружены немышечные актин и миозин (см. 1.1.2). Движущая сила тока цитоплазмы в клетках нителлы возникает на границе раздела фаз между эктоплазмой (где локализованы микротрубочки), находящейся в состоянии геля, и эндоплазмой в состоянии золя. С помощью электронной микроскопии в этой зоне обнаружены субкортикальные фибриллы, направленные в сторону движения цитоплазмы. Каждая фибрилла состоит из 50—100 микрофиламен-тов диаметром 5 — 6 нм, состоящих из Ф-актина. Нарушение структуры микрофиламентов (обработка клеток цитохалази-ном В) прекращает движение. Актиновые филаменты фукцио-нируют в комплексе с миозином эндоплазмы, который обладает АТРазной активностью. Предполагается, что движущую силу цитоплазмы обусловливают и взаимодействия актиновых микрофиламентов с микротрубочками эктоплазмы, связи между которыми возникают на границе экто- и эндоплазмы.
 Движение цитоплазмы осуществляется с затратой энергии АТР и нуждается в присутствии ионов Са2+ в концентрациях менее 0,1 мкмоль/л. В концентрации 1 мкмоль/л Са2+ингиби-рует движение цитоплазмы у нигеллы. Предполагается, что изменения уровня кальция в цитоплазме — важный регулятор структуры сократительных белков. Повышение концентрации Са2+ в цитоплазме (например, при раздражении) приводит к ее обратимой желатинизации (переходу из состояния золя в состояние геля) и прекращению движения. Желатинизация является результатом резкого ускорения полимеризации мономерного актина и образования трехмерной сети микрофиламентов. Удаление излишков Са2+ из цитоплазмы достигается за счет функциональной активности Са-АТРазы или Н+/Са2+ обмена в плазмалемме и, возможно, в мембранах ЭР и в то-нопласте. Митохондрии также способны поглощать излишки кальция.
Движение цитоплазмы осуществляется с затратой энергии АТР и нуждается в присутствии ионов Са2+ в концентрациях менее 0,1 мкмоль/л. В концентрации 1 мкмоль/л Са2+ингиби-рует движение цитоплазмы у нигеллы. Предполагается, что изменения уровня кальция в цитоплазме — важный регулятор структуры сократительных белков. Повышение концентрации Са2+ в цитоплазме (например, при раздражении) приводит к ее обратимой желатинизации (переходу из состояния золя в состояние геля) и прекращению движения. Желатинизация является результатом резкого ускорения полимеризации мономерного актина и образования трехмерной сети микрофиламентов. Удаление излишков Са2+ из цитоплазмы достигается за счет функциональной активности Са-АТРазы или Н+/Са2+ обмена в плазмалемме и, возможно, в мембранах ЭР и в то-нопласте. Митохондрии также способны поглощать излишки кальция.
Однако главным депо кальция в растительных клетках являются полигалактуроновые кислоты (пектины) клеточных стенок.
Средняя скорость движения цитоплазмы у разных клеток варьирует от 2 —5 мкм/с в пыльцевых трубках и корневых волосках до 50 мкм/с в междоузлиях нителлы и 1350 мкм/с в плазмодии миксомицетов.
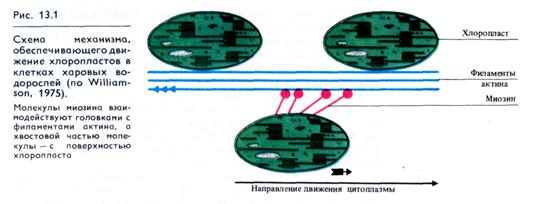
Такие крупные органоиды растительной клетки, как хлоро-пласты, не только пассивно переносятся с током цитоплазмы, но обладают и автономными движениями. Эту способность можно наблюдать в каплях цитоплазмы, изолированной из клеток нителлы. В каплях нет тока цитоплазмы (из-за отсутствия эктоплазмы), но сохраняется быстрое вращательное движение хлоропластов (1об/с). Хлоропласты связаны с пучками цито-плазматических микрофиламентов через миозин, головки молекул которого взаимодействуют с филаментами актина. Движение хлоропласта с использованием АТР возникает при взаимодействии актина и миозина благодаря изменению угла наклона молекул миозина по отношению к актину (рис. 13.1).
В основе локомоторных способов движения клеток лежит функционирование систем сократительных белков, обеспечивающих превращение химической энергии АТР в механическую энергию. Локомоторные движения у растений присущи клеткам, перемещающимся с помощью жгутиков.
 Перемещение всего организма в пространстве под влиянием односторонне действующих факторов (раздражителей) называется таксисом. Этот тип движения характерен для одноклеточных жгутиковых (монадных) водорослей, для гамет и зоос-пор водорослей, для сперматозоидов мхов, плаунов, хвощей и папоротников. Движения осуществляются по направлению к источнику питания (или от него), для нахождения клетки другого пола (хемотаксисы) либо как реакция на свет (фототаксисы). Фототаксисы служат приспособлением для лучшего использования света фототрофными клетками. При невысокой интенсивности света клетка движется к свету (положительный фототаксис), при излишне высокой — от него (отрицательный фототаксис). Свет воспринимается фоторецептором с пигментной системой, рецептирующей синий свет. Координирующую функцию выполняет «глазное пятно», содержащее кароти-ноиды и локализованное сбоку от рецептора. В процессе поступательного движения вперед клетка вращается и при каждом обороте фоторецептор на время затемняется «глазным пятном». Это корригирует направление движения к свету. Сигнал с фоторецептора на жгутик, по-видимому, передается с помощью микротрубочек.
Перемещение всего организма в пространстве под влиянием односторонне действующих факторов (раздражителей) называется таксисом. Этот тип движения характерен для одноклеточных жгутиковых (монадных) водорослей, для гамет и зоос-пор водорослей, для сперматозоидов мхов, плаунов, хвощей и папоротников. Движения осуществляются по направлению к источнику питания (или от него), для нахождения клетки другого пола (хемотаксисы) либо как реакция на свет (фототаксисы). Фототаксисы служат приспособлением для лучшего использования света фототрофными клетками. При невысокой интенсивности света клетка движется к свету (положительный фототаксис), при излишне высокой — от него (отрицательный фототаксис). Свет воспринимается фоторецептором с пигментной системой, рецептирующей синий свет. Координирующую функцию выполняет «глазное пятно», содержащее кароти-ноиды и локализованное сбоку от рецептора. В процессе поступательного движения вперед клетка вращается и при каждом обороте фоторецептор на время затемняется «глазным пятном». Это корригирует направление движения к свету. Сигнал с фоторецептора на жгутик, по-видимому, передается с помощью микротрубочек.
Движение монадной клетки обеспечивается волнообразным (от основания к вершине) движением жгутика. Основу двигательной системы составляют фибриллы — микротрубочки, идущие вдоль жгутика: две центральные и 9 пар периферических (9-2 + 2) (рис. 13.2). Микротрубочки жгутика состоят из субъединиц тубулина и относятся к стабильным микрогрубочкам. Периферические трубочки контактируют с центральными с помощью белковых радиальных связей, идущих к центру. Между собой периферические трубочки соединены белком пектином. У каждой пары периферических трубочек есть два отростка («ручки»), образованных из белка динеина.
 В основе движения жгутика лежит функционирование белковой системы тубулин-динеин, которая за счет энергии АТР обеспечивает механическое движение этого органа. Периферические микротрубочки жгутика скользят вдоль оси жгутика относительно друг друга и относительно центральной пары трубочек. Длина их при этом не меняется. Скольжение создается последовательным взаимодействием отростков, образованных из динеина, с тубулином соседних трубочек. Последовательное прикрепление, образование мостиков и подтягивание ручек приводит к смещению микротрубочек, подобно актиновым и миозиновым нитям в миофибрилле. Для возникновения мостиков между тубулином и динеином необходим магний. Процесс идет с затратой энергии АТР за счет деятельности строго специфичной к АТР АТРазы динеина, в равной степени активируемой ионами Са2 +, Mg2 +, Mn2 +, Со2+ с оптимумами рН
В основе движения жгутика лежит функционирование белковой системы тубулин-динеин, которая за счет энергии АТР обеспечивает механическое движение этого органа. Периферические микротрубочки жгутика скользят вдоль оси жгутика относительно друг друга и относительно центральной пары трубочек. Длина их при этом не меняется. Скольжение создается последовательным взаимодействием отростков, образованных из динеина, с тубулином соседних трубочек. Последовательное прикрепление, образование мостиков и подтягивание ручек приводит к смещению микротрубочек, подобно актиновым и миозиновым нитям в миофибрилле. Для возникновения мостиков между тубулином и динеином необходим магний. Процесс идет с затратой энергии АТР за счет деятельности строго специфичной к АТР АТРазы динеина, в равной степени активируемой ионами Са2 +, Mg2 +, Mn2 +, Со2+ с оптимумами рН


6,8 и 8,5. У мутантов хламидомонад, лишенных подвижности, АТРазная активность в жгутиках на 60 — 70% ниже, чем у подвижных форм.
Перемещение в пространстве корневых волосков, пыльцевых трубок, гиф грибов, протонемы мхов осуществляется за счет верхушечного роста. Это высокополяризованный тип роста, при котором в клетках соблюдается строгая пространственная локализация интенсивности синтеза стенки вдоль продольной оси клетки. Рост происходит путем активного локального секреторного процесса.
В кончиках растущих верхушечным ростом клеток содержится множество везикул различной электронной плотности, производных АГ и ЭР. Другие органоиды расположены на некотором расстоянии от кончика.
По данным циторадиоавтографии в кончике (верхушке) клетки обнаружен градиент секреторной и синтетической активности: в гифах грибов через 1 мин инкубации [3Н]глюкоза (рис. 1 3.3, А) или [3Н]ацетилглюкозамин (рис. 13.3, Б) в 50 раз активнее включаются в апикальный 1 мкм, чем в участок стенки на расстоянии 50 — 75 мкм от верхушки. Для верхушечного роста характерно отсутствие в цитоплазме куполообразного кончика микротрубочек, которые появляются в цилиндрической части клетки. Для процесса секреции необходим кальций. Например, для роста пыльцевых трубок традесканции концентрация Са2+в среде должна быть не ниже 0,1 ммоль/л, но не выше 1 ммоль/л.
Показано, что для верхушечного роста очень важен транспорт секреторных везикул к кончику клетки, которые доставляют материалы для синтеза стенки, а также синтазы и лити-ческие ферменты. Литические ферменты разрыхляют структуру стенки, делая ее неспособной противостоять высокому тургор-ному давлению. Микрофибриллы стенки раздвигаются, и новые компоненты встраиваются при работе синтаз в растянутую тургорным давлением разрыхленную стенку. В кончике растущей клетки микрофибриллы целлюлозы (или хитина у грибов) откладываются без строгой ориентации.

В процессе эволюции у растений возник специфический способ движения за счет необратимого растяжения клеток. Этот способ движения лежит в основе удлинения осевых органов, увеличения площади листовых пластинок и тех форм настий, которые осуществляются путем роста клеток растяжением. Необратимое растяжение клеток обеспечивает прикрепленному растению возможность движения к источникам питания.
 Рост растяжением включает в себя образование в клетке центральной вакуоли, накопление в ней осмотически активных веществ, поглощение воды и размягчение и растяжение клеточных стенок. Возникающее тургорное давление служит основной силой, растягивающей клеточную стенку. Растяжение клеточных стенок поддерживается включением в них новых молекул полисахаридов. Стенка оказывает на содержимое клетки противодавление, равное тургорному давлению, что определяет тонус клетки и ткани. Одновременно с растяжением клетки синтезируются компоненты цитоплазмы.
Рост растяжением включает в себя образование в клетке центральной вакуоли, накопление в ней осмотически активных веществ, поглощение воды и размягчение и растяжение клеточных стенок. Возникающее тургорное давление служит основной силой, растягивающей клеточную стенку. Растяжение клеточных стенок поддерживается включением в них новых молекул полисахаридов. Стенка оказывает на содержимое клетки противодавление, равное тургорному давлению, что определяет тонус клетки и ткани. Одновременно с растяжением клетки синтезируются компоненты цитоплазмы.
 Растяжение регулируется гормональной системой. Основную роль в регуляции роста растяжением выполняет ИУК. Ауксин вырабатывается в верхушке побега и, перемещаясь в зону растяжения, индуцирует рост клеток, готовых перейти к растяжению. В растягивающихся клетках ИУК взаимодействует с рецепторами, локализованными в цитоплазматической мембране. Одним из результатов этого взаимодействия являются активация выделения ионов Н+ из клеток и подкис-ление фазы клеточных стенок. Одновременно развивается гиперполяризация мембранного потенциала. Таким образом, активация ауксином Н+-помпы плазмалеммы является одним из ранних событий в индукции роста растяжением. Подкисление фазы клеточных стенок создает условия для их разрыхления: вытеснение Са2+ из пектатов стенок, ослабление части водородных связей, создание рН, благоприятного для деятельности в стенках кислых гидролаз, увеличивают растяжимость стенок. Одновременно с этим ИУК в комплексе с рецепторами активирует синтез белков и РНК. Активация синтеза РНК и белков необходима для поддержки начавшегося роста растяжением. Усиление дыхания обеспечивает энергетические затраты на все эти процессы.
Растяжение регулируется гормональной системой. Основную роль в регуляции роста растяжением выполняет ИУК. Ауксин вырабатывается в верхушке побега и, перемещаясь в зону растяжения, индуцирует рост клеток, готовых перейти к растяжению. В растягивающихся клетках ИУК взаимодействует с рецепторами, локализованными в цитоплазматической мембране. Одним из результатов этого взаимодействия являются активация выделения ионов Н+ из клеток и подкис-ление фазы клеточных стенок. Одновременно развивается гиперполяризация мембранного потенциала. Таким образом, активация ауксином Н+-помпы плазмалеммы является одним из ранних событий в индукции роста растяжением. Подкисление фазы клеточных стенок создает условия для их разрыхления: вытеснение Са2+ из пектатов стенок, ослабление части водородных связей, создание рН, благоприятного для деятельности в стенках кислых гидролаз, увеличивают растяжимость стенок. Одновременно с этим ИУК в комплексе с рецепторами активирует синтез белков и РНК. Активация синтеза РНК и белков необходима для поддержки начавшегося роста растяжением. Усиление дыхания обеспечивает энергетические затраты на все эти процессы.
Тропизмы — это ростовые движения растений, обусловленные изгибанием или искривлением органов в ответ на факторы среды, действующие односторонне. Они осуществляются в растущих частях растений и, как правило, являются следствием более быстрого роста клеток растяжением на одной стороне побега, корня или листа.
Согласно теории тропизмов Холодного-Вента под влиянием односторонне действующих факторов (раздражителей) в органах индуцируется поперечная электрополяризация тканей, в  результате чего транспорт ИУК, а следовательно, и рост становятся асимметричными. По современным представлениям, в механизме тропизмов принимают участие и другие фи-тогормоны (например, абсцизовая кислота в корнях). В зависимости от природы раздражителей различают гео-, фото-, тигмо-, гидро-, аэро-, термо-, электро-, травмо- и автотро-пизмы. При положительных тропизмах движение направлено в сторону раздражающего фактора, при отрицательных — от него. Органы, располагающиеся вдоль градиента раздражителя, называются ортотропными, под прямым углом — диа-тропными, а под любым другим углом — плагиотропными. С помощью тропизмов осуществляется такая ориентация органов в пространстве, которая обеспечивает наиболее эффективное использование факторов питания, а также служит для защиты от вредных воздействий.
результате чего транспорт ИУК, а следовательно, и рост становятся асимметричными. По современным представлениям, в механизме тропизмов принимают участие и другие фи-тогормоны (например, абсцизовая кислота в корнях). В зависимости от природы раздражителей различают гео-, фото-, тигмо-, гидро-, аэро-, термо-, электро-, травмо- и автотро-пизмы. При положительных тропизмах движение направлено в сторону раздражающего фактора, при отрицательных — от него. Органы, располагающиеся вдоль градиента раздражителя, называются ортотропными, под прямым углом — диа-тропными, а под любым другим углом — плагиотропными. С помощью тропизмов осуществляется такая ориентация органов в пространстве, которая обеспечивает наиболее эффективное использование факторов питания, а также служит для защиты от вредных воздействий.
Геотропизм. Все растительные клетки и организмы развиваются в гравитационном поле Земли. Геотропизм — ориентация в пространстве и изгибание под действием гравитационного поля вследствие разной скорости роста противоположных сторон органа. В почве при прорастании семян, клубней (т. е. в темноте) растения ориентируются прежде всего по гравитационному полю. У наземных растений корни, растущие по направлению действия силы тяжести, обладают положительным геотропизмом, а надземные органы, растущие против действия силы тяжести,— отрицательным.
В геотропизме различают рецепцию силы тяжести, передачу раздражения и реакцию на раздражение — ростовый изгиб. Время воздействия, необходимое для получения эффекта при геотропизме, составляет 2 мин, а время реакции — 10 — 90 мин. Механизм гравирецепции имеет порог, ниже которого реакция отсутствует. Ряд подпороговых стимулов суммируется, если периоды времени между ними не превышают времени стимуляции в 10 раз. В условиях моделирования действия силы тяжести на клиностате было выяснено, что существует обратная корреляция между силой и временем экспозиции, необходимым для вызывания пороговой реакции (закон количества раздражения).
Восприятие силы тяжести связано с воздействием давления на клеточные мембраны (плазмалемму или ЭР) находящихся в цитоплазме тяжелых частиц — статолитон. В качестве стато-литов могут выступать амилопласты, хлоропласты, АГ, а также включения в клетках типа друз щавелевокислых солей, карбонатов и др. Клетки, содержащие статолиты, называют ста-тоцитами. В корне роль статоцитов выполняют клетки центральной части корневого чехлика (рис 13.4), а статолитами служат амилопласты. Обнаружено, что мембраны ЭР также могут перераспределяться под действием силы тяжести и рас полагаются в апикальной части клетки, так что амилопласты передают давление мембранам ЭР.
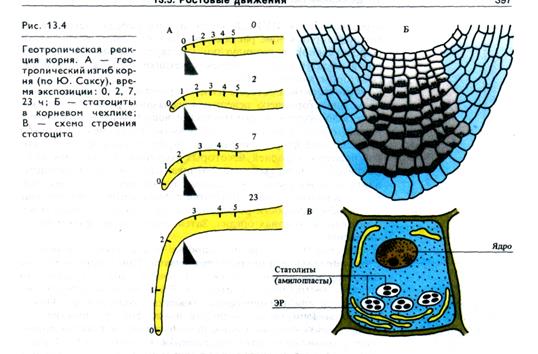
У органов побега (колеон-тилей, гипокоптилей и междоузлий) гравитационное раздражение воспринимается по всей длине растущей зоны. В клетках побега крахмальные зерна также располагаются по направлению действия силы тяжести, однако геореакция побегов обрат-на реакции корней.
О процессах, происходящих после перемещения статолитов, известно мало. Их давление на мембраны может приводить к сдвигам в мембранном транспорте, поляризации клеток и к поперечной поляризации органа в целом. При этом нижняя часть стеблей и корней, приведенных в горизонтальное положение, приобретает электроположительный заряд.
Согласно гипотезе Холодного — Вента в результате поляризации органа геостимуляцией индуцируется латеральный транспорт ауксина как отрицательно заряженного аниона к нижней стороне органа. Действительно, в клетках нижней части органов количество его увеличивается по сравнению с верхней. Это приводит к усилению роста нижней части горизонтально расположенного стебля и его геогропическому изгибу вверх. У корней же, у которых чувствительность к ауксину значительно выше, увеличение концентрации ИУК в нижней части тормозит рост и корни изгибаются вниз.
 Однако имеются данные, не согласующиеся с этой гипотезой. Оказалось, что для электрической поляризации необходимо присутствие ауксина, а сама поперечная электрополяризация является, по-видимому, не причиной, а следствием перераспредения ИУК. В корне ауксин передвигается не от кончика корня к зоне растяжением, а в обратном направлении (акропетально); в геоиндукции участвует какой-то ингибитор роста, образующийся в корневом чехлике. Возможно, этим ингибитором является АБК.
Однако имеются данные, не согласующиеся с этой гипотезой. Оказалось, что для электрической поляризации необходимо присутствие ауксина, а сама поперечная электрополяризация является, по-видимому, не причиной, а следствием перераспредения ИУК. В корне ауксин передвигается не от кончика корня к зоне растяжением, а в обратном направлении (акропетально); в геоиндукции участвует какой-то ингибитор роста, образующийся в корневом чехлике. Возможно, этим ингибитором является АБК.
Фототропизм. Ростовые изгибы органов растений под влиянием одностороннего освещения называют фототропизмами. При положительном фототропизме воспринимается не направление света, а разность в количестве света между теневой и освещенной сторонами органа. Отрицательный фототропизм наблюдается у корней некоторых растений, у ризоидов печеночников и заростков папоротника. Листья могут осуществлять диафототропизмы, занимая положение, перпендикулярное к падающему свету. Фототропические изгибы обусловлены различием в скорости роста растяжением на освещенной и неосвещенной сторонах органа. Затененная сторона растет более интенсивно.
Явление фототропизма наиболее полно изучено в опытах с этиолированными проростками злаков. При увеличении дозы односторонне падающего света (произведение интенсивности света на время) наблюдаются 1-й, 2-й и 3-й максимумы положительной фототропической реакции колеоптиля. Между этими максимумами — отрицательные фототропические изгибы. Первая положительная фототропическая реакция подчиняется закону количества раздражения. Как показал Ч. Дарвин, сенсорной (чувствительной) зоной к действию одностороннего освещения у проростков злаков является верхушка колеоптиля. Ростовой изгиб, возникая под верхушкой, распространяется к основанию колеоптиля. Признаки фототропической реакции обнаруживаются через 20 — 25 мин (при благоприятной температуре). Продолжительность реакции (от начала до конца изгибания) достигает 24 ч.
Согласно гипотезе Н. Г. Холодного — Ф. Вента фототропический стимул вызывает поперечную электрическую поляризацию клеток в верхушке колеоптиля, причем неосвещенная сторона приобретает положительный заряд, что приводит к перераспределению ауксина. ИУК передвигается на затененную сторону, в результате чего рост этой стороны усиливается. В настоящее время доказано, что при одностороннем освещении колеоптилей тормозится транспорт ИУК на освещенной стороне и наблюдается латеральное перемещение ауксина на затененную сторону.
Однако первичная поперечная поляризация, вызванная односторонним освещением, не сопровождается электрической поляризацией. Первичную поляризацию можно обнаружить, если через 1 — 3 ч после одностороннего освещения обедненных ауксином декапитированных отрезков гипокотиля подсолнечника ввести ауксин. Тогда развиваются как электрическая поперечная поляризация, так и ростовой изгиб. Таким образом, электрическая поляризация не причина, а следствие перераспределения ИУК.
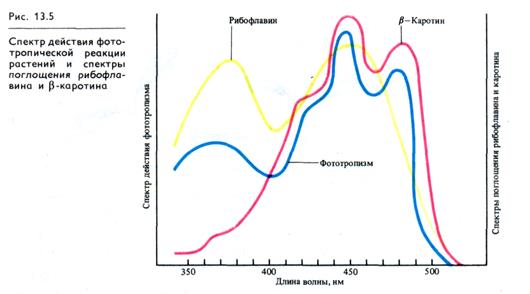
В спектре действия фототропизма обнаруживаются один максимум в ультрафиолетовой (370 нм) и три — в синей обла сти спектра (425, 445 и 474 нм), совпадающих с зонами поглощения рибофлавина, цитохрома b5 и β-каротина (рис. 13.5).
Возможно, каротиноиды служат экраном, контрастирующим освещенность на двух сторонах органа, а рибофлавин входит в состав флавопротеинового рецептора синего света, получившего название криптохрома. В плазмалемме клеток колеопти-лей кукурузы найдены флавопротеиновая оксидоредуктаза и цитохром b5. Предполагается, что возбуждение этой системы синим светом приводит к торможению базипетального транспорта ИУК на освещенной стороне и латеральному оттоку ауксина.
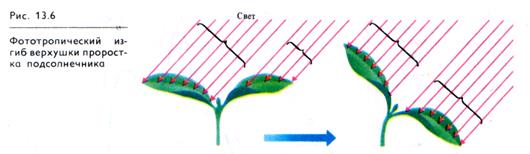
Однако в зеленых проростках двудольных растений боковое освещение не вызывает латерального перераспределения ауксина. У этих растений в клетках освещенной стороны междоузлия содержится больше ингибитора роста (ксантоксина). Разная степень освещенности молодых верхушечных листьев также сказывается на изгибе растущего междоузлия. Из более освещенного листа в стебель поступает больше ауксина и эта сторона междоузлия растет более интенсивно (рис. 13.6). Диа-фототропические движения листьев двудольных связаны с перераспределением ауксина в черешках (как в колеоптилях злаков) и с усилением образования ИУК в затененных участках листовых пластинок (или со снижением образования ингибитора роста). С помощью этого механизма затененные участки листа выходят из тени и создается эффект «мозаики листьев».
Хемотропизм. Ростовая двигательная реакция на градиент химических соединений называется хемотропизмом. Он обнаружен у корней, пыльцевых трубок, железистых волосков росянки и у других объектов. Клетками рецептируются градиенты различных химических веществ. Это могут быть кислоты и щелочи (раздражающими стимулами служат ионы Н+ и ОН-), трофические факторы (минеральные соли и органические вещества), гормоны, аттрактанты и другие регуля-торные соединения. Растения реагируют ростовыми движениями в направлении градиента (положительный хемотропизм) или от него (отрицательный хемотропизм).
При этом для реакции существенны как химическая природа раздражителя, так и его концентрация: при низкой концентрации реакция может быть положительной, но превышение некоторой оптимальной концентрации приводит к отрицательной хемотропической реакции. У корней хемотропическая чувствительность локализована в их кончике. Затем раздражение передается к зоне растяжения, где наблюдается ростовая реакция.
Пороговые концентрации для хемотропного раздражения у грибов довольно низки. Так, у гиф мукоровых пороговая концентрация глюкозы составляет 0,01 %, а азотнокислого аммония — 0,05 %причем гифой хорошо различается десятикратный перепад концентраций раздражающего вещества. Пыльцевые трубки отвечают положительной хемотропической реакцией на кусочки ткани либо вытяжки из тканей столбика или семяпочки. Выяснено, что раздражителями в данном случае выступают сахара (сахароза), ионы кальция, причем пыльцевые трубки реагируют ростом на пятикратный перепад концентраций этих веществ.
Кроме реакций на растворимые в воде соединения у растений известны хемотропические ответы на газообразные вещества. У корней отмечена положительная реакция на O2 и CO2. К хеморецепторным реакциям относится также гидротропизм (ориентация по градиенту влажности) корней и гиф грибов (положительный), спорангиев фикомицетов (отрицательный) и других растительных объектов (см. рис. 5.12).
 Тигмотропизм. Тигмотропизмы, или гаптотропизмы, — это ростовые изгибы в ответ на прикосновение. Примером могут служить тигмотропические движения колеоптилей, усиков некоторых лазящих растений, кончиков воздушных корней и листовых черешков ряда растений.
Тигмотропизм. Тигмотропизмы, или гаптотропизмы, — это ростовые изгибы в ответ на прикосновение. Примером могут служить тигмотропические движения колеоптилей, усиков некоторых лазящих растений, кончиков воздушных корней и листовых черешков ряда растений.
Другие виды тропизмов. Помимо действия света, силы тяжести, механических раздражителей и химических веществ, двигательные ростовые реакции вызываются и другими раздражителями. Так, при одностороннем действии теплового излучения развивается термотропическая реакция. Для корней гороха показано, что величина отклонения корня от места нагрева возрастала в 5 раз с увеличением температуры от 26 до 41 С (отрицательный термотропизм). Выявлены температуры, при которых происходит обращение термотропической реакции. Для проростков гороха такая переходная точка наблюдалась при 32°, для кукурузы — при 38 °С. Ниже этой точки преобладали положительные изгибы, выше — отрицательные.
 Электротропизм (гальванотропизм) проявляется при помещении органа растения в электростатическое поле или при пропускании тока через растения. Пропускание тока (20 мкА) поперек апикального участка колеоптиля в течение 2 мин вызывает его изгиб. При помещении проростков в электрическое поле (между пластинами конденсатора) побеги изгибаются к положительно заряженной, а корни — к отрицательно заряженной пластине. Однако для этого нужно высокое напряжение поля (сотни вольт на 1 см).
Электротропизм (гальванотропизм) проявляется при помещении органа растения в электростатическое поле или при пропускании тока через растения. Пропускание тока (20 мкА) поперек апикального участка колеоптиля в течение 2 мин вызывает его изгиб. При помещении проростков в электрическое поле (между пластинами конденсатора) побеги изгибаются к положительно заряженной, а корни — к отрицательно заряженной пластине. Однако для этого нужно высокое напряжение поля (сотни вольт на 1 см).
Ростовая реакция на одностороннее поранение называется травмотропизмом. Впервые травмотропизм был обнаружен Ч. Дарвином на корнях. При одностороннем повреждении верхушки корня механическим, химическим или температурным воздействием в зоне роста наблюдается изгиб в сторону от нанесенного повреждения (отрицательный травмотропизм). Действие химических, термических и других факторов, использованных в чрезмерно высоких дозах, также может сводиться к травмотропической реакции.

Большой интерес представляет феномен автотропизма, под которым понимают способность органов выправлять тропические изгибы после того, как раздражение, вызвавшее изгиб, перестало действовать. Например, если прикосновение оказалось кратковременным, закрученный усик опять выпрямляется. После раздражения изогнутые железистые волоски росянки возвращаются в исходное положение. Согласно одной из гипотез причиной разгибания может быть механическое сдавливание клеток вогнутой стороны органа, что воспринимается как одностороннее раздражение и вызывает отрицательную тропическую реакцию.
Настии — обратимые движения (изгибы) органов с дорси-вентральным строением в ответ на изменение диффузно действующих факторов внешней среды (например, открывание и закрывание цветков при смене дня и ночи). Направленность настических движений зависит от структуры самого органа. Это более совершенная форма движения, чем тропизмы. У некоторых растений настии происходят в результате неравномерного роста клеток растяжением. При более быстром росте верхней стороны орган (лист, лепесток) изгибается книзу (эпинастия), при обратном соотношении скоростей роста — кверху (гипонастия).
По отношению к тем или другим раздражителям настии делят на фото-, термо-, гидро-, никти-, хемо-, тигмо-, сейсмо-, травмо- и электронастии. Настические движения обеспечивают защиту органов (закрывание цветков, опускание листьев) или захват предметов (движения усиков, железистых волосков росянки).
 Фотонастии. Фотонастические движения свойственны молодым листьям и цветкам многих видов. Большинство дневных цветков закрывается с уменьшением интенсивности дневного света, а у ночных, наоборот, в этих условиях наблюдается открывание цветков. Эти реакции можно вызвать экспериментально в любое время суток, затеняя или освещая цветки. В ряде случаев эти фотонастические движения цветков осуществляются благодаря различной скорости роста верхней и нижней сторон лепестков в ответ на изменение освещенности.
Фотонастии. Фотонастические движения свойственны молодым листьям и цветкам многих видов. Большинство дневных цветков закрывается с уменьшением интенсивности дневного света, а у ночных, наоборот, в этих условиях наблюдается открывание цветков. Эти реакции можно вызвать экспериментально в любое время суток, затеняя или освещая цветки. В ряде случаев эти фотонастические движения цветков осуществляются благодаря различной скорости роста верхней и нижней сторон лепестков в ответ на изменение освещенности.
Листовые пластинки молодых листьев, способных к фотона-стиям, днем располагаются горизонтально, а вечером меняют свое положение путем искривления черешков или листовой пластинки. У бальзамина, например, затенение листа в полдень ускоряет рост на верхней стороне черешков, в результате чего лист опускается листовой пластинкой вниз. Ростовые движения органов происходят до тех пор, пока у них сохраняется способность к росту растяжением.

Термонастии. При повышении температуры ускоряется рост внутренней стороны лепестков тюльпанов и крокусов и цветки раскрываются, а при понижении температуры рост интенсивнее на внешней стороне основания лепестков и цветки закрываются. Скорость движения определяется быстротой изменения температуры. Лепестки уже реагируют на изменение в 0,2 °С.
Тигмонастии. В физиологическом плане тигмонастии впервые начал изучать Ч. Дарвин. Объектами его исследований были, в частности, усики лазящих растений. Усики большинства лазящих растений имеют дорсивентральное строение и реагируют на прикосновение закручиванием (рис. 13.7). Наиболее чувствителен к прикосновению самый кончик усика, но при этом он не отвечает на падающие капли дождя или прикосновение гладкой стеклянной палочки, а реагирует на прикосновение шершавой палочки, на шерстяную нить, т. е. на предметы, создающие эффект трения. Усики гороха отвечают ростовым движением на раздражение массой 0,25 мг. Массу такой величины еще не воспринимают рецепторы кожи млекопитающих.
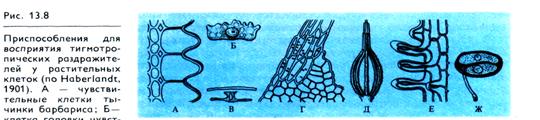
Рецепция стимула происходит в эпидермальных клетках любого участка кончика усика, которые для улучшения восприятия трения могут иметь дополнительные приспособления в виде сосочков, выступов и т. д. (рис. 13.8). Физиология рецепции контактного раздражения неизвестна. Рецепция механического раздражения, по-видимому, взаимосвязана с эффектами света в закручивании усика. В темноте в ответ на прикосновение усик гороха не закручивается, но освещение растения даже через 90 мин после прикосновения индуцирует закручивание. Таким образом, поляризация усика, возникшая при одностороннем касании, «запоминается» и реализуется уже на свету. Поляризация кончика усика может выражаться в изменении проницаемости клеточных мембран на разных сторонах возбужденного усика.
Способ передачи раздражения до конца не выяснен. Обнаружено возникновение в кончике усика нераспространяющегося потенциала действия, предполагается также участие в передаче раздражения этилена и латерального транспорта ауксина. Обработкой ауксином или этиленом можно вызвать закручивание усика без механического раздражения.
Реакция клеток усика на прикосновение включает, как правило, два типа процессов. Вначале в ответ на прикосновение происходит быстрое, но слабое тигмонастическое тургорное движение (сокращение), когда нижняя сторона усика теряет  тургор и становится вогнутой. При продолжающемся одностороннем раздражении включается ростовая тропическая реакция клеток на другой стороне усика, в результате чего усик закручивается.
тургор и становится вогнутой. При продолжающемся одностороннем раздражении включается ростовая тропическая реакция клеток на другой стороне усика, в результате чего усик закручивается.
 Нутации (от лат. nutatio — колебание, качание) — круговые или колебательные движения органов растений, в ряде случаев имеющие эндогенный (автономный) характер. Так, растущий побег совершает качания, в результате чего его верхушка колеблется относительно продольной оси. Аналогичные колебательные движения наблюдаются у корней при их росте. Этот тип движений называется круговой нутацией. Эти нутации осуществляются за счет идущих по кругу местных ускорений роста клеток в зоне растяжения. В основе ростовых круговых нутаций стеблей и корней лежат геотропическая корректировка в гравитационном поле и автотропизм.
Нутации (от лат. nutatio — колебание, качание) — круговые или колебательные движения органов растений, в ряде случаев имеющие эндогенный (автономный) характер. Так, растущий побег совершает качания, в результате чего его верхушка колеблется относительно продольной оси. Аналогичные колебательные движения наблюдаются у корней при их росте. Этот тип движений называется круговой нутацией. Эти нутации осуществляются за счет идущих по кругу местных ускорений роста клеток в зоне растяжения. В основе ростовых круговых нутаций стеблей и корней лежат геотропическая корректировка в гравитационном поле и автотропизм.
Вьющиеся растения. Особенно хорошо круговые нутации выражены у стеблей вьющихся растений (лиан). Длительность одного оборота у этих растений — от 2 до 12 ч. Большинство лиан завивается влево, т. е. верхушка побега движется против часовой стрелки (рис. 13.9). Вправо изгибается, например, стебель хмеля. Нередко завивание сопровождается скручиванием побега.
Молодой побег вьющегося растения сначала растет вертикально. В результате диагеотропической реакции его верхушка изгибается и занимает горизонтальное положение. Вслед за этим наблюдаются круговые нутации с участием латерального геотропизма, который выражается в том, что в горизонтальном или косом положении у завивающегося побега стимулируется не рост верхней или нижней стороны, как при обычной геотропической реакции, а рост боковой стороны. Вследствие этого побег обвивается вокруг опоры. Следует отметить, что у вьющихся растений чувствительность к прикосновению не обнаружена.
Движения вьющихся растений, по-видимому, зависят от присутствия гиббереллинов и флавоноидов. Ими вьющиеся растения особенно богаты. Обнаружено, что многие невьющиеся растения начинают виться после обработки гиббереллинами.
 Лазающие растения. Усики лазящих растений также совершают постоянные круговые нутации, однако в отличие от вьющихся растений эти нутации носят эндогенный характер. Один оборот может занимать от 40 мин до нескольких часов. У многих лазящих растений круговые движения совершает вся верхняя часть побега.
Лазающие растения. Усики лазящих растений также совершают постоянные круговые нутации, однако в отличие от вьющихся растений эти нутации носят эндогенный характер. Один оборот может занимать от 40 мин до нескольких часов. У многих лазящих растений круговые движения совершает вся верхняя часть побега.
Круговые нутации лиан и лазящих растений служат для поиска опоры, необходимой для движения к свету.
Выше рассмотрен ряд ростовых настий. В большинстве случаев настические изгибы — это тургорные движения. Они также обусловлены дорсивентральным строением органов и вызываются теми же диффузно действующими факторами внешней среды. Однако тургорные настий не зависят от процессов роста и обусловливают двигательную активность тех органов, которые закончили свой рост.
Обратимые тургорные движения осуществляются благодаря увеличению и уменьшению в вакуолях специализированных клеток концентрации осмотически активных веществ (К+, С1-, малата), в результате чего соответственно увеличиваются или уменьшаются поглощение воды и тургорное давление. Примерами могут служить медленные тургорные движения устьиц или опускание прекративших рост листьев на ночь(ноч ной сон). Другой тип тургорных движений происходит за счет быстрого обратимого выделения жидкости из клеток в специализированных тканях (например, в сочленениях листьев мимозы).
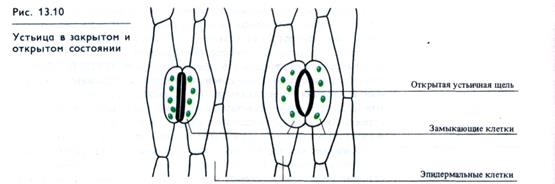
Движения устьиц. Примером обратимых движений являются движения устьиц. Эти движения обусловлены особенностью строения клеточных стенок замыкающих клеток. Утолщенной и нерастяжимой является та часть оболочки, которая обращена к устьичной щели. Остальная часть замыкающей клетки покрыта тонкой клеточной стенкой, способной эластически (обратимо) растягиваться (рис. 13.10). Такое строение приводит к тому, что при возрастании тургорного давления и увеличении объема вакуоли замыкающих клеток устьичные щели открываются (см. 5.4.3).
Степень их открытия определяется освещенностью, уровнем ССЬ в тканях и их оводненностью. Особенно чувствительны устьица к синим лучам. При восходе солнца устьица открываются при небольших интенсивностях света.
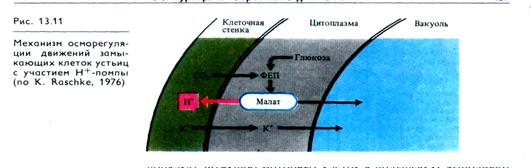
Открывание устьиц зависит от усиления выхода ионов Н+ из замыкающих клеток. Этот процесс связан с активацией Н+-помпы плазмалеммы в ответ на действие внешних или внутренних факторов. Освещение растения, адаптированного к темноте, приводит к усилению деятельности Н+- насосов плазмалеммы и тонопласта и гиперполяризации мембранного потенциала замыкающих клеток (рис. 13.11). Выход ионов Н + из замыкающей клетки сопровождается одновременным проникновением ионов К+ в эту клетку и затем в ее вакуоль. Калий поступает из свободного пространства и из окружающих клеток. У галофитов функцию калия может выполнять натрий.
Транспорт К+ в вакуоль происходит вместе с входом в нее анионов двух типов: ионов хлора, которые в зависимости от вида растения уравновешивают 5—100% поступившего К1", и анионов малата. Хлор транспортируется в замыкающие клетки из других клеток устьичного комплекса, а малат образуется в самих замыкающих клетках. Индуцированное светом усиление выхода Н+ из замыкающих клеток сопровождается некоторым подщелачиванием цитоплазмы (до рН 7,2 и выше), что увеличивает активность фосфоенолпируваткарбоксилазы (ФЕП-карбоксилазы), максимум активности которой наблюдается при рН 7,5 — 8,0. Фермент ускоряет процесс карбоксили-рования фосфоенолпирувата, образующегося из глюкозы при расщеплении крахмала, что приводит к возрастанию содержания малата в замыкающих клетках устьиц. Не исключена также возможность синтеза малата из гликолата в микротелах замыкающих клеток. Уровень малата в них регулируется отрицательной обратной связью между количеством образовавшегося малата и активностью ФЕП-карбоксилазы, величиной рН цитоплазмы и наличием СО2 в тканях. Именно необходимостью СО2 для карбоксилирования ФЕП и образования малата объясняется чувствительность устьиц к изменениям концентрации СО2 в тканях.
Увеличение в вакуолях замыкающих клеток содержания осмотически активных веществ (К+, малата, С1-) приводит к усилению поступления воды в вакуоли, к возрастанию тур-горного давления, обратимому растяжению эластичных участков клеточных стенок и открыванию устьичной щели. В регуляции открывания устьиц могут участвовать и цитокинины, способные усиливать поглощение К+ замыкающими клетками устьиц, активируя, возможно, Н+,К+ -АТРазу плазмалеммы.
 При закрывании устьиц в замыкающих клетках содержание К +, СГ и малата уменьшается. Этот процесс регулируется СО2 и абсцизовой кислотой. При высоких концентрациях СО2 внутриклеточная среда в замыкающих клетках закисляется, что снижает активность ФЕП-карбоксилазы. АБК, содержание которой возрастает при водном дефиците (см. 5.4.3), вызывает закрывание устьиц, нарушая Н+/К+ обмен в замыкающих клетках (гигронастия).
При закрывании устьиц в замыкающих клетках содержание К +, СГ и малата уменьшается. Этот процесс регулируется СО2 и абсцизовой кислотой. При высоких концентрациях СО2 внутриклеточная среда в замыкающих клетках закисляется, что снижает активность ФЕП-карбоксилазы. АБК, содержание которой возрастает при водном дефиците (см. 5.4.3), вызывает закрывание устьиц, нарушая Н+/К+ обмен в замыкающих клетках (гигронастия).
Таким образом, процесс открывания и закрывания устьиц связан с транспортом ионов через плазмалемму и тонопласт замыкающих клеток и изменением в них тургорного давления. Сходные механизмы лежат в основе всех тургорных настиче-ских движений органов растений в ответ на смену диффузно действующих факторов внешней среды.
Тургорные фотонастии. Смена условий освещения в течение суток вызывает медленные ритмические движения листьев многих бобовых (фасоли, клевера и т. д.) и ряда растений других семейств (например, кислицы). Эти движения называют никтинастическими, или движениями «сна».
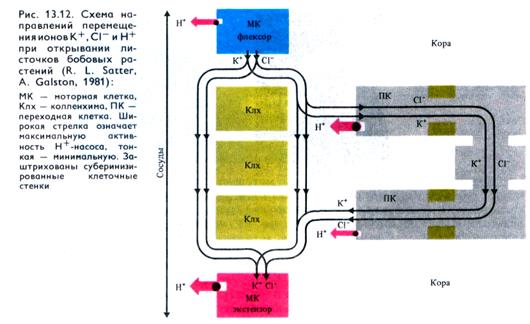
Движения листьев обеспечиваются деятельностью специализированных образований: подушечек в сочленениях между стеблем и черешком, между черешком и пластинкой листа. У мимозы стыдливой имеются три порядка таких сочленений: между стеблем и главным черешком (подушечки первого порядка), между главным и боковыми черешками (второго порядка) и в основаниях мелких листовых пластинок (третьего порядка). Функцию моторных клеток в подушечках выполняют паренхимные клетки коры. Если моторные клетки при складывании листьев способны терять тургор и восстанавливать его при открывании, то их называют экстензорными (разгибателями).
Клетки, тургор которых возрастает при складывании листьев и снижается при их открывании, называют флексорными (сгибателями). Клеточные стенки экстензорных клеток эластичнее, чем у флексорных. Если экстензоры находятся на верхней стороне подушечки (например, у третичных подушечек стыдливой мимозы и акации шелковой), то листочки на ночь складываются вверх. Если экстензорные клетки расположены снизу подушечки, то листья складываются вниз (например, вторичные подушечки фасоли, кассии).
Никтинастические движения листьев связаны с изменениями транспорта ионов и тургора в моторных клетках. При этом моторные клетки взаимодействуют с другими клетками коры и клетками колленхимы подушечки. Как и в устьичных клетках, изменения ионных потоков при смене режима освещения связаны с деятельностью Н+-помп, выводящих Н + из моторных клеток, с транспортом К+, С1- и других анионов. При движении взаимодействуют Н+-помпы моторных клеток верхних и нижних частей подушечки, работающие в противоположных фазах (рис. 13.12). Складывание листочков с наступлением темноты обусловлено снижением активности Н+-помпы экстензорных клеток, что вызывает выход из вакуоли этих клеток К+ и С1-, а вслед за ними воды в утолщенные клеточные стенки колленхимы и в флексорные клетки, где активность Н+-помпы продолжает оставаться высокой. Это поддерживает поступление в них К +, анионов и Сахаров с помощью Н+-котранспортного механизма. Уменьшение тургора в экстензорных клетках приводит к складыванию листьев. Открывание листьев вызывается активацией Н+-помпы в экстензорных клетках, увеличением содержания в них К+, С1-, Сахаров, повышением тургора и объема клеток. При этом во флексорных клетках тургор снижается.
Никтинастические движения могут регулироваться фитогор-монами (например, ауксином), влияющими на деятельность Н+-помпы. Обработка листьев этиленом приводит к хорошо выраженной эпинастии (их опусканию). Движения чувствии тельны к действию температуры, причем ее снижение ускоряет закрывание листьев и замедляет открывание (термонастии).
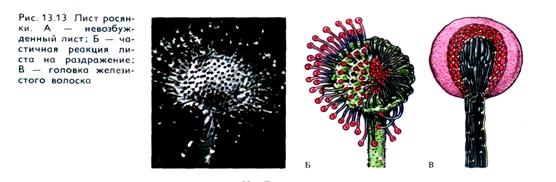
Тигмонастии. Железистые волоски росянки отвечают на прикосновение шершавых предметов изгибанием и выделением муравьиной кислоты. На капли дождя росянка не реагирует. Чувствительность к механическому раздражению (трению) очень высока. Реакция начинается от действия отрезка волоска (нитки) массой 0,82 мкг. Раздражение воспринимается самым кончиком железистого волоска. Затем раздражение передается по цитоплазме нижележащим клеткам. Визуально это выражается в сокращении («агрегации», как назвал Дарвин) вакуолей. Скорость проведения 8 мм/мин. Волосок изгибается ближе к основанию, т. е. место рецепции отделено от места реакции. Время от момента раздражения до начала реакции у росянки составляет около 1 мин. В настоящее время известно, что стимуляция механорецепторов головок волосков росянки вызывает появление нераспространяющихся рецепторных потенциалов в соответствии с силой и продолжительностью раздражения. Если продолжительность и амплитуда рецепторных потенциалов достаточно велики, то индуцируется возникновение распространяющихся потенциалов действия. Так обеспечивается передача раздражения к месту реакции.
Хемонастии. Изгибы на химическое раздражение у росянки выражены даже в большей степени, чем на механическое. Хе-морецепторной функцией обладает также головка волоска (рис. 13.13). Результатом хеморецепции служит индукция сгибания волоска и выделения пищеварительного сока. Хеморецепторы росянки наиболее чувствительны к азотсодержащим веществам и, по данным Ч. Дарвина, реагируют уже на 0,24 — 0,48 мкг карбоната аммония.
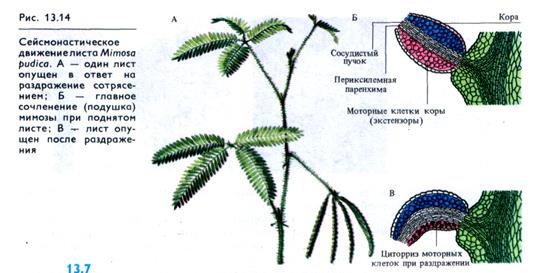
 К быстрым тургорным движениям относятся сейсмонасти-ческие (т. е. индуцируемые сотрясением) движения сложных листьев некоторых бобовых (мимозы, клевера), кислицы, венериной мухоловки и других растений. Наиболее изучен механизм сейсмонастий у мимозы, у которой при сотрясении (или в результате действия другого раздражителя) главный черешок опускается, черешки второго порядка сближаются, а листочки попарно складываются вверх, наклоняясь косо вперед (рис. 13.14). Такие же движения происходят и с наступлением ночи (никтинастия), однако в этом случае они развиваются медленно.
К быстрым тургорным движениям относятся сейсмонасти-ческие (т. е. индуцируемые сотрясением) движения сложных листьев некоторых бобовых (мимозы, клевера), кислицы, венериной мухоловки и других растений. Наиболее изучен механизм сейсмонастий у мимозы, у которой при сотрясении (или в результате действия другого раздражителя) главный черешок опускается, черешки второго порядка сближаются, а листочки попарно складываются вверх, наклоняясь косо вперед (рис. 13.14). Такие же движения происходят и с наступлением ночи (никтинастия), однако в этом случае они развиваются медленно.
В ответ на механический удар или встряхивание нижние (зк-стензорные) клетки главного сочленения мимозы способны быстро (в течение секунд) терять тургор, что приводит к опусканию листа (см. рис. 13.14). Поднимается лист медленнее (30 — 60 мин). В настоящее время показано, что раздражение вызывает возникновение в листе потенциала действия с амплитудой 50—100 мВ и продолжительностью спайка около 3 с, который распространяется по черешку со скоростью 0,5 — 4 см/с. В месте перехода черешка в подушечку первоначальный ПД индуцирует в подушечке ПД другого типа с латентным периодом 0,2 — 0,4 с. Через 0,05 — 0,1 с после возникновения ПД в подушечке электрическое сопротивление нижних моторных клеток снижается на 5—10% по сравнению с верхними. Это вызвано выходом ионов К+ и С1 из экстензорных клеток. Выход ионов из вакуоли сопровождается выходом жидкости в межклетники, что и приводит к потере тургора клетками. Потоки ионов из клеток могут усиливаться вследствие открывания калиевых и хлорных каналов тонопласта и плазмалеммы увеличенной концентрацией свободного Са2+. При раздражении кальций входит в цитоплазму из клеточных стенок и, возможно, из вакуолей моторных клеток. Предполагается также, что в быстром движении могут участвовать белковые сократительные системы моторных клеток.
Физиологическое значение опускания листьев у мимозы при сотрясении, по-видимому, связано с предотвращением повреждений от сильных ливней и ураганных ветров.

Несмотря на разнообразие отмеченных способов движения, необходимо еще раз подчеркнуть, что для растительного мира в целом наиболее характерно движение за счет роста растяжением. Особенность этого способа движения состоит не только в том, что он осуществляется за счет осмотических сил, но и в том, что он необратим. Поэтому рост растяжением у растений является одновременно и элементом морфогенеза.
Большинство исследователей считают, что высшие растения произошли от зеленых водорослей, причем прогрессивное развитие растительного мира могло осуществляться в следующем порядке: хламидомонадные → хлорококковые →улотриксовые →хетофоровые →первые наземные высшие растения (риниофи-ты) → папоротниковидные → голосеменные и цветковые. Каким образом в этом ряду изменялась двигательная активность растительных организмов? У монадных форм зеленых водорослей, населяющих главным образом пресные воды, движение происходит с помощью жгутиков. Жгутики — это выросты цитоплазмы, и клеточные стенки у монад, таким образом, замкнуты не полностью. Очевидно, в связи с этим у всех монадных пресноводных форм есть пульсирующие вакуоли, необходимые для осморегуляции, причем для удаления воды из цитоплазмы, поступающей в нее согласно осмотическим законам, тратится по половины метаболической энергии клетки. У хлорокок-ковых в вегетативном состоянии жгутики отсутствуют и клеточная оболочка полностью замкнута. Можно думать, что противодавление клеточной стенки у хлорококковых оказалось эффективным способом предотвращения поступления излишней воды в клетку, при этом устраняется необходимость функционирования системы сократительных вакуолей. Но при этом хлорококковые утратили способность к самостоятельному передвижению.
В ходе дальнейшей эволюции хлорококковые дали начало нитчатым зеленым водорослям, простейший представитель которых — улотрикс. Прикрепленная к грунту нить улотрикса состоит из коротких бочонкообразных клеток. Удлинение такой нити достигается за счет деления всех клеток нити и роста дочерних клеток до размера материнских. Удлинение нити необходимо для «движения» к свету, так как свет, падающий сверху, — единственный лимитирующий фактор для жизнедеятельности водоросли. Вода, СО2, минеральные соли имеются в окружающей среде в достаточном количестве.
Удлинение нити за счет деления клеток — процесс очень медленный. Появление у растительных клеток способности быстро удлиняться путем образования большой центральной вакуоли и растяжения клеточной стенки явилось приобретением, которое можно назвать ароморфозом. Действительно, для индивидуальной клетки ее удлинение и постенное расположение цитоплазмы оказались оптимальными для поглощения света хлоропластами. Нитчатая водоросль, удлиняющаяся за счет растяжения клеток, получила возможность гораздо быстрее «двигаться» к свету, поскольку длина клетки за сравнительно короткое время увеличивается в десятки и сотни раз. Такая форма движения по необходимости должна быть необратимой и поэтому одновременно является элементом морфогенеза. Удлинение клеток за счет роста рястяжением оказалось настолько удачной формой движения, что наряду с фотосинтезом стало основой развития растительного мира. Легко убедиться, что рост растяжением характерен только для растительных организмов: ни у бактерий, ни у животных такого способа роста клеток не существует, так как рост растяжением возник у растений как способ движения многоклеточных автотрофных организмов (В. В. Полевой, Т. С. Саламатова, 1985).
У высших растений продольный рост растяжением обеспечивает увеличение длины стеблей и корней, а изодиаметрический рост клеток растяжением становится основой развертывания листовых пластинок и увеличения площади листовой поверхности. Другие формы движений также включают в себя рост растяжением. Например, круговые нутации и тропизмы приобретают свойства обратимого движения за счет чередования растяжения клеток в разных участках осевого органа. Ч. Дарвин полагал, что способность к круговым движениям у вьющихся и лазящих растений и тропизмы генетически связаны с круговыми нутациями.
В ходе дальнейшей эволюции у растений все в большей степени развивается способность к обратимым движениям на основе изменяющегося тургорного давления. Такой механизм прежде всего возник уже у первых высших наземных растений при формировании устьиц. Затем медленные тургорные движения (настии) начинают использоваться для движения листьев, закрывания и открывания цветков. Наконец, появляются быстрые обратимые тургорные движения — сейсмонастии. Эволюцию всех этих форм движения у растений можно представить в виде следующей схемы:
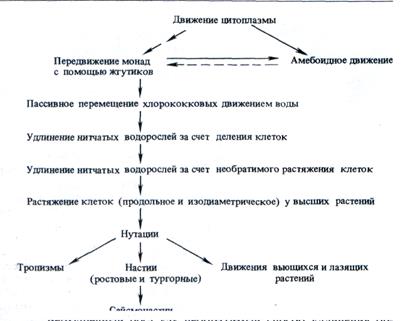
Верхушечный рост как необратимый способ удлинения органов возник у прокариот (гифы актиномицетов и др.) и представлен у всех таксонов растительного мира (ризоиды водорослей, протонема мхов, корневые волоски высших растений).
Таким образом, у растений наблюдается прогрессивная эволюция способов движения от необратимого удлинения за счет роста растяжением к обратимым ростовым движениям (круговые нутации, тропизмы), затем к тургорным движениям (на-стии), которые уже не связаны с ростом растяжением, и, наконец, к быстрым тургорным движениям (сейсмонастии), где скорость передачи гормонального сигнала недостаточна и для управления двигательной активностью используется электрический импульс (потенциал действия). Причем у растений эволю-ционно продвинутых таксонов сохраняются в различных комбинациях и все ранее возникшие формы движения.,
Главный способ движения органов растений связан с особым типом роста клеток — ростом растяжением. За счет зон роста растяжением в стебле и корне происходит более или менее интенсивное удлинение осевых органов в зависимости от условий окружающей среды (необратимый способ движения). Более обратимы гео-, фото-, хемо-и другие типы тропизмов (ростовых изгибов) и полностью обратимы настии, многие из которых осуществляются за счет изменения тургор-ного давления в клетках (тургорные изгибы). Возможно, все эти формы движений возникли из круговых нутаций, присущих всем растениям, особенно в молодом возрасте. Особый тип удлинения клеток — верхушечный рост — характерен для корневых волосков, пыльцевых трубок, гиф грибов. Регуляция ростовых и тургорных движений осуществляется с участием фитогормонов.
Двигательная активность растений необходима им для оптимизации питания, для процессов размножения, а в ряде случаев — и для защиты.
 Глава 14
Глава 14
 2015-05-26
2015-05-26 13404
13404
