Классическая теория электролитической диссоциации применима только к слабым электролитам.
Для растворов сильных электролитов в 1923 г. Дебаем и Хюккелем была разработана электростатическая теория.
В теории электролитов очень важным является вопрос о распределении ионов в растворе. Распределение ионов определяется соотношением энергии электростатического взаимодействия и энергии хаотического (теплового) движения ионов. Оказывается, что эти энергии сравнимы по величине, поэтому реальное распределение ионов в электролите является промежуточным между упорядоченным и беспорядочным.
Электростатические силы стремятся установить такое распределение, при котором каждый ион окружен только ионами противоположного знака, но этому противодействует хаотическое движение ионов, приводящее к беспорядочному распределению. Эти противоположные тенденции приводят к тому, что около каждого иона образуется своеобразная ионная атмосфера, в которой преобладают ионы противоположного (по сравнению с центральным ионом) знака.
Основные положения теории Дебая-Хюккеля:
1. Ионы – материальные точки с зарядами, т.е. размеры их значительно меньше расстояний между ними (такое допущение возможно только в разбавленных растворах).
2. Взаимодействие между ионами носит чисто кулоновский характер (ион-дипольное взаимодействие с молекулами растворителя и образование ассоциатов не учитываются).
3. Диэлектрическая проницаемость раствора равна диэлектрической проницаемости растворителя.
4. Распределение ионов вокруг центрального иона подчиняется законам статистической термодинамики (распределение Больцмана).
Теория позволяет вычислить потенциал, создаваемой ионной атмосферой ΨИ.А:
ΨИ.А. = – 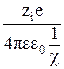 ,
,
где zi – заряд центрального иона;
е – заряд электрона;
ε – диэлектрическая проницаемость растворителя;
ε0 – диэлектрическая проницаемость вакуума (электрическая постоянная);
1/χ – толщина ионной атмосферы.
Для водных растворов электролитов при температуре Т = 298К толщина ионной атмосферы равна:
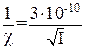 ,
,
где I – ионная сила раствора электролита, которую рассчитывают как полусумму произведений концентраций ионов на их заряды во второй степени:
I = 1/2 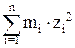 .
.
Здесь mi – моляльные концентрации ионов,
zi – заряды ионов.
Теория позволяет рассчитать коэффициенты активности отдельных ионов и средние ионные коэффициенты активности растворов электролитов.
lgγi = – 0,51zi2 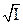 . (1)
. (1)
Это предельное уравнение Дебая-Хюккеля, справедливое для очень разбавленных растворов с I < 0,01m.
При 0,01m < I < 0,1m учитывают конечные размеры ионов:
lgγi = – 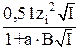 ,
,
где а – среднее расстояние при максимальном сближении ионов;
а = (3 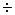 4) 10–10м для большинства ионов.
4) 10–10м для большинства ионов.
В – константа, равная 0,33 ·1010 для водных растворов электролитов при Т = 298К.
Поэтому (а · В) для водных растворов электролитов можно принять примерно равным 1.
lgγi = – 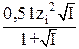 (2)
(2)
При I > 0,1m lgγi = – 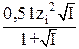 + 0,2 I. (3)
+ 0,2 I. (3)
Это уравнение учитывает взаимодействие ионов с молекулами растворителя и изменение (уменьшение) диэлектрической проницаемости раствора электролита с ростом его концентрации. 0,2 – эмпирическая константа для водных растворов электролитов при Т = 298К.
 2015-05-26
2015-05-26 17862
17862








