2.1. Три состояния вещества
Вещества могут находиться в трех агрегатных состояниях - газообразном, жидком и твердом. Газообразное состояние вещества характеризуется беспорядочным расположением частиц, имеющих очень слабую связь между собой и находящихся в непрерывном и беспорядочном тепловом движении. Частицы вещества в газообразном состоянии стремятся заполнить весь возможный объем.
Жидкое состояние является промежуточным между газообразным и твердым состояниями и характеризуется упорядоченным расположением частиц (молекул, атомов) в малых объемах, а не в объемах всего вещества. Жидкость не имеет определенной формы и принимает форму сосуда, в котором находится.
Твердое состояние вещества характеризуется определенным упорядоченным расположением атомов, равновесием между силами притяжения и отталкивания, наличием определенного объема и формы. В зависимости от упорядочения расположения частиц твердые вещества могут быть кристаллическими и аморфными.
Переход вещества из одного агрегатного состояния определяется внешними условиями (температурой, давлением) и сопровождается изменением различных свойств. Одной из особенностей некристаллических аморфных веществ является отсутствие строго определенных температур перехода из одного состояния в другое. Например, стекло, которое является аморфным веществом, при нагревании размягчается и постепенно переходит из твердого состояния в жидкое. Кристаллические материалы (металлы) переходят из твердого состояния в жидкое и из жидкого в газообразное при определенной температуре и давлении. Для металлов изменение давления может менять характер перехода из одного агрегатного состояния в другое (рис.2.1.).
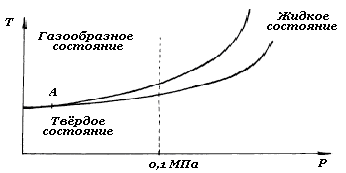
Рис.2.1.Схематическое изображение взаимного расположения агрегатного состояния металлов от температуры и давления
При давлениях выше точки А переход металла из твердого в газообразное состояние происходит через жидкое. Если давление оказывается ниже точки А, то происходит переход вещества из твердого состояния сразу в газообразное. Такой переход носит название сублимации. Процесс перехода металла из одного агрегатного состояния в другое протекает при изменении внешних условий (давления, температуры) и сопровождается резким изменением физических и механических свойств.
2.2. Энергетические условия кристаллизации
При переходе из жидкого состояния в твердое образуется кристаллическая решетка, возникают кристаллы. Такой процесс называется кристаллизацией. Переход системы из одного состояния в другое происходит с затратой некоторой работы. Энергетическое состояние системы, в которой имеется огромное число охваченных тепловым движением частиц (атомов, молекул), при постоянном давлении характеризуется особой термодинамической функцией G, называемой свободной энергией (энергией Гиббса), которая определяется выражением
G=U-TS, (2.1)
где U –внутрення энергия системы; Т – абсолютная температура; S – энтропия.
Энтропия - физическая величина, характеризующая состояние системы. Связь между притоком тепла к системе и изменением ее энтропии описывается соотношением dS=dQ/T (dQ – бесконечно малое количество теплоты, сообщенной системе при температуре T). После достижения системой наиболее вероятного состояния, результирующего изменения S практически не происходит. В этом случае полагают, что система достигла равновесия.
Свободная энергия G оказывает большое влияние на устойчивость системы. Чем больше свободная энергия системы, тем менее устойчива система.
Система стремится занять более устойчивое состояние, в котором свободная энергия меньше. Для всех веществ, при любых температурах выше абсолютного нуля, энтропия S>0. Следовательно, график функции G=U-TS имеет вид, приведенный на рисунке 2.2. Естественно, что энтропия жидкого тела Sж больше чем твердого Sт (больший беспорядок в структуре жидкости) при одной и той же температуре. Поэтому кривая G (T) для жидкого состояния вещества идет круче, чем для твердого состояния.
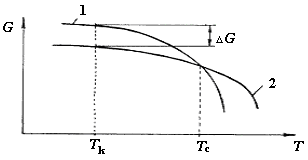
Рис.2.2. Изменение свободной энергии в зависимости от температуры для металлов идком (1) и твердом (2) состояниях
Выше температуры Ts меньшей свободной энергией обладают вещества в жидком состоянии, а при температурах ниже Тs-в твердом. Следовательно выше Ts вещество должно находиться в жидком состоянии, а при температурах. ниже Ts – в твердом.
При температуре Ts свободные энергии жидкого и твердого состояния равны. Эта температура Т и есть равновесная или теоретическая температура кристаллизации.
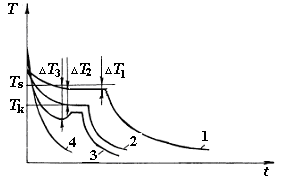
Рис.2.3. Кривые охлаждения металла при кристаллизации
Но при этой температуре процесс кристаллизации не будет происходить, так как Gж=Gтв. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе, то есть сопровождался снижением свободной энергии.
Это возможно тогда, когда жидкость будет охлаждена ниже температуры Ts и возникнет разность свободных энергий DG. Разность между теоретической и фактической температурами, при которой может протекать процесс кристаллизации, называют степенью переохлаждения (DT = Ts - Tk). Степень переохлаждения зависит от природы материала. Она увеличивается с повышением чистоты металла и с ростом скорости охлаждения. Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30 К. Процесс перехода металла из жидкого состояния в кристаллическое изображают в координатах время – температура (рис. 2.3.). При очень медленном охлаждении DТ невелика и процесс кристаллизации протекает при температуре, близкой к Тs (кривая 1). На кривой охлаждения появляется горизонтальная площадка (остановка в снижении температуры), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. При повышении скорости охлаждения (кривая 2) степень переохлаждения (DТ) возрастает, что приводит к ускорению процесса кристаллизации; при этом протяженность площадки на кривых охлаждения сокращается. У некоторых металлов при больших скоростях охлаждения скрытая теплота кристаллизации выделяется в первый момент кристаллизации настолько бурно, что температура скачкообразно повышается, приближаясь к равновесной (кривая 3). Из сопоставления кривых охлаждения видно, чем выше скорость охлаждения, тем большее переохлаждение может быть достигнуто.
Металлы переохлаждаются в сильной степени лишь при очень больших скоростях охлаждения (миллионы градусов в секунду). При таких скоростях охлаждения кристаллические зародыши не образуются, и металл затвердевает в аморфном состоянии. Такой металл называется аморфным или металлическим стеклом, который применяется на практике (аморфные металлические ферромагнитные пленки). При охлаждении обычных аморфных тел (неорганические стекла) спад температуры происходит монотонно времени охлаждения при небольших скоростях, и на кривой охлаждения не образуется горизонтальная площадка (кривая 4).
2.3. Гомогенная (самопроизвольная) и гетерогенная
кристаллизации
Процесс кристаллизации, как впервые установил Д.К.Чернов, состоит из двух одновременно идущих элементарных процессов. Первый заключается в рождении мельчайших частиц кристаллов, которые называются центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров. Кристаллы могут зарождаться самопроизвольно (самопроизвольная или гомогенная кристаллизация) или расти на имеющихся готовых центрах кристаллизации (несамостоятельная или гетерогенная кристаллизация). При самопроизвольной кристаллизации в результате переохлаждения сплава ниже равновесной температуры Ts образуются устойчивые, способные к росту кристаллические зародыши. Образованию зародышей способствуют флуктуации энергии, т. е. отклонения энергии группировок атомов в отдельных зонах жидкого металла от некоторого среднего значения. Процесс образования кристаллов путем зарождения центров кристаллизации и их роста представлен на рис. 2.4.
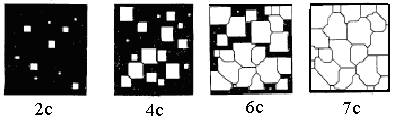
Рис. 2.4. Схема процесса кристаллизации.
Пока образовавшиеся кристаллы окружены жидкостью, они имеют правильную форму. Но по мере их роста правильная форма кристаллов нарушается вследствие столкновения и сращивания, внешняя форма оказывается зависимой от условий соприкосновения растущих кристаллов. В результате этого растущие кристаллы, имевшие сначала геометрически правильную форму, после затвердевания получают неправильную внешнюю форму; такие кристаллы называют кристаллитами, или зернами.
Скорость процесса кристаллизации и строение металла после перехода его в твердое состояние определяются скоростью зарождения центров кристаллизации и скоростью роста кристаллов. Скорость зарождения центров кристаллизации определяется числом зародышей ЧЗ, возникающих в единицу времени и в единице объема; имеет размерность 1/мм3×с. Скорость роста кристаллов СР определяется увеличением линейных размеров кристалла в единицу времени (мм/с). Скорость зарождения центров кристаллизации и скорость роста кристаллов определяются степенью переохлаждения расплава.
На рис.2.5. графически представлены изменения величины ЧЗ и СР в зависимости от степени переохлаждения DТ.
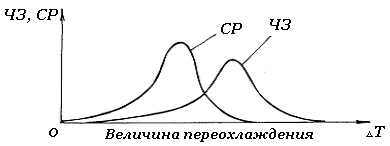
Рис.2.5. Схема зависимости ЧЗ и СР от степени переохлаждения
При теоретической температуре кристаллизации (DТ=0) значения ЧЗ и СР равны нулю и процесс кристаллизации не происходит, что находиться в полном соответствии с изложенным выше положением о необходимости переохлаждения для протекания процесса кристаллизации. С увеличением переохлаждения ЧЗ и СР возрастают, достигают максимума и затем снижаются практически до нуля при больших величинах переохлаждения.
Увеличение ЧЗ и СР с ростом DТ при малых степенях переохлаждения обусловлены тем, что разность свободной энергии жидкого и твердого состояния DG возрастает и это способствует ускорению процесса кристаллизации, т.е. скорости образования зародышей и их роста. Однако для образования и роста зародышей необходимо диффузионное перемещение атомов в жидкости. Поэтому снижение ЧЗ и СР при больших степенях охлаждения вызвано тем, что вследствие уменьшения скорости диффузии образование зародышей и их рост затруднен. При очень больших DТ, диффузионная подвижность атомов настолько мала, что большой выигрыш в DG жидкого и твердого состояния оказывается недостаточным для образования зародышей и их роста, и тогда ЧЗ и СР становятся равными нулю. В этом случае не происходит перестройка атомов из хаотического их расположения в жидкости в правильное в кристалле, т.е. в материале достигается аморфное состояние. Органические вещества, силикаты весьма склонны к переохлаждению, поэтому в них образуется аморфная структура. Металлы не склонны к переохлаждению. Чтобы получить замороженную структуру расплава (аморфную), металлы необходимо переохладить в сильной степени. Это достигается при скорости охлаждения 105- 107К/с.
Размер образовавшихся кристаллов зависит от соотношения скоростей зарождения центров кристаллизации и роста кристаллов при данной DТ. При малых степенях переохлаждения СР> ЧЗ и поэтому образуются немногочисленные крупные кристаллы (крупнозернистая структура). При больших DТ скорость образования зародышей возрастает, количество зерен увеличивается, а размер их уменьшается. В результате этого в охлажденном металле получается мелкозернистая структура.
Размер зерна влияет на механические свойства металлов: при мелкозернистой структуре вязкость и пластичность повышаются.
Самопроизвольное (гомогенное) образование зародышей на основе фазовых и энергетических флуктуаций может происходить только в высокочистых металлах и при больших степенях переохлаждения. В реальных условиях процессы кристаллизации и характер образующейся структуры в значительной мере зависит от готовых центров кристаллизации. Такими центрами являются тугоплавкие частицы неметаллических включений, оксиды, интерметаллические соединения, которые всегда присутствуют в расплаве. Если примеси имеют одинаковую кристаллическую решетку с решеткой затвердевшего расплава (так называемые изоморфные примеси), а расхождение в межатомных размерах не превышает 7 – 9%, то они играют роль центров кристаллизации. Такое сходство примесей с кристаллизующим металлом приводит к снижению размера кристаллов при меньшем переохлаждении. Чем больше примесей, тем больше центров кристаллизации, тем меньше получается зерно. Такая кристаллизация называется несамостоятельной или гетерогенной.
Измельчения структуры металлов и сплавов посредством введения в жидкий расплав специальных примесей называют модифицированием, а примеси – модификаторами. Эти примеси практически не изменяют химического состава материала, а вызывают при кристаллизации измельчение структуры и, как следствие, улучшают механические свойства.
Кристаллические решетки многих веществ после превращения из жидкого в твердое состояние при дальнейшем охлаждении не сохраняют свою первоначальную форму, а претерпевают изменение. Существование вещества в виде нескольких кристаллических форм в твердом состоянии носит название полиморфизма или аллотропии. Различные кристаллические формы одного вещества называются полиморфными или аллотропическими модификациями.
Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом свободной энергии. Полиморфное превращение происходит вследствие того, что образование новой кристаллической решетки сопровождается уменьшением свободной энергии. Как и при кристаллизации из жидкой фазы, полиморфное превращение протекает при определенном переохлаждении относительно равновесной температуры для возникновения разности свободной энергии системы двух модификаций.
Превращение одной аллотропической формы в другую при охлаждении сопровождается выделением скрытой теплоты кристаллизации, а превращение при нагреве сопровождается поглощением тепла. Поэтому эти превращения на термической кривой (рис.2,6) отмечаются горизонтальным участком. Хотя эти явления происходят теоретически при одной температуре, однако, практически в процессе охлаждения переход наблюдается при более низкой вследствие переохлаждения.
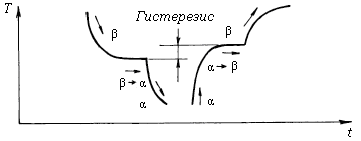
Рис.2.6. Кривые охлаждения и нагрева металла, имеющего полиморфные превращения
Аллотропические формы обозначаются символами a, b, g и т.д., которые в виде индексов добавляются к обозначению элемента. Форма существования при более низкой температуре обозначается a, а при более высокой b,g и т.д. Полиморфные превращения могут существовать как в чистых элементах (Fe, Ti, Sn, Co, Mn, Zr), так и в соединениях (SiO2, Cu2S, Cu2Te). Железо имеет несколько аллотропических форм превращения: Fea, Feb, Feg, Fed(a) ; титан две формы: Tia, Tib. Олово существует в двух модификациях: Sna, Snb. Ниже +18° С устойчиво a - олово (серое олово), не обладающее металлическими свойствами; при охлаждении появляется на b - олове в виде отдельных бугорков на поверхности (известно под названием ''оловянной чумы''). Sna имеет решетку алмаза, Snb (белое олово) имеет тетрагональную объемоцентрированную кристаллическую решетку и обладает металлическими свойствами. Хотя температура равновесия Sna ®Snb равна + 18°С, превращение при этой температуре происходит очень медленно. Максимальная скорость роста кристаллов получается при DТ= 50°С, поэтому окончательный переход из b в a модификацию происходит при – 32°С.
Полиморфные превращения сопровождаются скачкообразным изменением физико-механических свойств: удельного объема, теплоемкости, теплопроводности, электропроводности, прочности и пластичности и т.д.
Многие металлы при нагревании теряют свои магнитные свойства. Магнитные превращения отличаются от аллотропических превращений. Магнитные превращения не связаны с изменением формы решетки, а обусловлены изменением взаимодействия внутренних и внешних электронных оболочек атомов.
2.5. Форма кристаллов
Размер и форма зерен, образующихся при кристаллизации, зависят от скорости и направления отвода тепла и температуры расплава, от наличия примесей и других факторов.
Рост кристаллов происходит по дендритной (древовидной) схеме (рис.2.7).
Максимальная скорость роста кристаллов происходит, в первую очередь, в направлениях перпендикулярных к плотноупакованным плоскостям.
В результате этого первоначально образуются длинные ветви 1 (дендритные оси первого порядка или главные оси дендритов). Затем на осях первого порядка происходит зарождение коротких ветвей второго порядка 2, на которых появляются оси третьего порядка 3 и т.д. В последнюю очередь идет кристаллизация в участках между ветвями. Дендриты растут до тех пор, пока не соприкасаются друг с другом. После этого окончательно заполняются межосные пространства, и дендриты превращаются в кристаллы неправильной формы, которые называют зернами или кристаллитами.
В момент своего образования дендрит является монокристаллом, но правильная форма его затем искажается в результате столкновения и срастания частиц на поздних стадиях кристаллизации.
Дендритная структура образуется при значительных переохлаждениях и только в определенных кристаллографических направлениях.
Размер дендритов зависит от скорости охлаждения - чем выше скорость, тем меньше их размеры. Дендритное строение характерно для макро- и микроструктуры литых сплавов.
Условия отвода теплоты при кристаллизации сильно влияют на форму кристаллов. Они растут преимущественно в направлении, обратном отводу теплоты. Поэтому при направленном теплоотводе образуются вытянутые (столбчатые) кристаллы.
Структура реального слитка состоит из трех зон: наружной мелкозернистой 1, зоны столбчатых кристаллов 2, внутренней зоны крупных равновесных кристаллов 3 (рис.2.8).
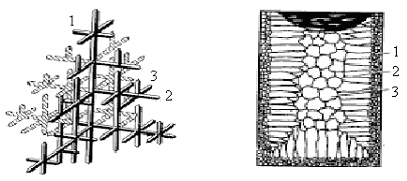
Рис.2.7. Схема строения Рис. 2.8. Схема макроструктуры
дендрита слитков
Кристаллизация наружной зоны протекает в условиях максимального переохлаждения, когда имеется большое число зародышей. В этом случае структура получается мелкозернистой. Эта зона очень тонка и не всегда обнаруживается невооруженным глазом.
После образования наружной зоны кристаллов уменьшается теплоотвод из-за увеличения теплового сопротивления и повышения температуры стенки литейной формы. Поэтому в следующей зоне переохлаждение расплава значительно меньше и меньше скорость образования зародышей кристаллизации и их количество. В результате из небольшого количества зародышей растут нормально ориентированные к поверхности теплоотвода столбчатые кристаллы.
В середине слитка, где наблюдается наименьшее переохлаждение и не ощущается направленного отвода тепла, образуются равновесные кристаллы больших размеров.
Жидкий сплав имеет больший объем, чем закристаллизованный, поэтому в процессе кристаллизации он сокращается в объеме, что приводит к образованию пустот, называемых усадочными раковинами; они могут быть сконцентрированы в одном месте (в верхней части отливки при хорошем раскислении) или рассеяны по всему объему. Слитки сплавов обычно имеют химическую неоднородность по объему. Например, в сталях снизу вверх и от поверхности к центру увеличивается концентрация углерода и вредных примесей – серы и фосфора.
Химическая неоднородность по отдельным зонам слитка называется зональной ликвацией, которая отрицательно сказывается на различных свойствах материалов. Встречаются и другие виды ликвации. Например, гравитационная ликвация образуется в результате различия в удельном весе жидкой и твердой фаз. Для снижения гравитационной ликвации используются большие скорости переохлаждения, а применение космической технологии позволяет полностью устранить этот дефект.
2.6. Направление кристаллизации и выращивание
монокристаллов
При кристаллизации сплавов с нерегулируемым отводом тепла образуется зона столбчатых кристаллов, вытянувшихся в направлении, перпендикулярном оси слитка
Для получения слитков со столбчатыми кристаллами, ориентированными вдоль оси слитка, применяют метод направленной кристаллизации, который заключается в отводе тепла вдоль оси слитка из жидкой фазы в твердую фазу. С целью предотвращения зарождения большого числа кристаллов вдоль зоны кристаллизации поддерживается постоянный градиент температуры, а температуру расплава в жидкой ванне сохраняют выше температуры ликвидуса.
Если при этом создать условия роста кристалла из одного центра кристаллизации, то во всем объеме слитка формируется один кристалл – монокристалл. Метод направленной кристаллизации является основой для выращивания монокристаллических материалов, получивших широкое применение в радиоэлектронике – монокристаллов полупроводников, ферритов (ферроганов, ортоферритов, феррошпинелей), активных лазерных диэлектриков и т.д. Наибольшее распространение получили методы Вернейля, Бриджмена, Чохральского и зонной плавки.
Рассмотрим схему процесса выращивания по методу Чохральского, широко используемого при получении полупроводниковых монокристаллов (рис.2.9).
Метод Чохральского состоит в вытягивании монокристалла из расплава. Для этого используется готовая затравка 2, которая крепится к штоку 1. В качестве затравки применяется монокристалл с малым количеством дефектов и примесей и определенной кристаллографической ориентацией, которую желательно получить в растущем монокристалле.
При постепенном опускании штока затравка вводится в поверхностный слой расплава, выдерживается для оплавления поверхности и установления равновесия в системе жидкость – кристалл.
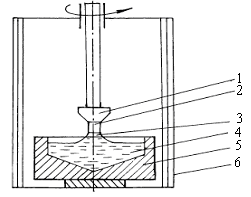
Рис.2.9. Схема установки для выращивания монокристаллов по методу Чохральского: 1 – шток; 2 – затравка; 3 – растущий монокристалл; 4 – расплав; 5 – графитовый тигель с нагревателем; 6 – рабочая камера
Затем шток с затравкой медленно поднимаются со скоростью, не превышающей скорость кристаллизации (1–2 мм/мин).
Тянущийся за затравкой жидкий столбик расплава, удерживаемый поверхностным напряжением, попадая в область более низких температур над поверхностью ванны, кристаллизуется, наследуя структуру затравки, Для получения симметричной формы монокристалла и равномерного распределения примесей в нем шток и тигель вращаются в противоположном направлении с определенной скоростью. Процесс вытягивания монокристаллов сопровождается, если это необходимо, легированием. Легирующие элементы в строго контролируемых количествах вводятся в расплав. Диаметр вытягиваемого слитка зависит от скорости выращивания и температуры расплава – повышение температуры расплава приводит к снижению диаметра, понижение – к увеличению диаметра монокристалла.
Для получения однородных монокристаллов важен учет движения расплава в процессе кристаллизации. В условиях Земли, т.е. наличия гравитации, возможно возникновение потоков в расплаве в результате конвекции, обусловленной градиентом температуры, градиентом плотности, поверхностного натяжения и др. Все это приводит к нестабильности роста кристалле, несовершенству кристаллического строения и к изменению свойств монокристалла. В последнее время интересные перспективы открываются при выращивании монокристаллов в космосе, где сочетается высокий вакуум (до 10–13 Па) и ничтожно малая гравитация в невесомости. Это способствует лучшей очистке от примесей и снижению конвекций в расплаве. Монокристаллы, выращенные в космосе, совершеннее по структуре, распределению легирующих добавок и лучше по свойствам.
2.7. Аморфное состояние сплавов
Зависимости скорости зарождения центров кристаллизации (ЧЗ) и скорости роста кристаллов (СР), изображенные на рис.2.5, показывают, что если достичь степень переохлаждения DТ, при котором ЧЗ и СР равны нулю, то можно зафиксировать структуру жидкого состояния. Материалы с такой структурой называют аморфными.
Для металлов и их сплавов долгое время считалось, что получить аморфное состояние невозможно, так как в жидком состоянии они мало склонны к переохлаждению ввиду быстрого роста параметров кристаллизации ЧЗ и СР. В настоящее время различными методами удается достичь охлаждения расплавов со скоростью 105– 108 °С/с, что дает возможность получать аморфное состояние в чистых металлах, полупроводниковых материалах и сплавах. Сверхвысокие скорости охлаждения реализуются при направлении жидкого расплава на внешнюю или внутреннюю поверхность вращающегося барабана, изготовленного из материалов высокой теплопроводности или прокаткой между холодными валками жидкого расплава, подаваемого в виде струи. Такими методами получают аморфные пленки толщиной 10 – 100 мкм и аморфную тонкую нить следующих составов:
сплавы переходных металлов (Al, Co, Ni, Mn и др.) и неметаллов (Si, P, B, C и др.), которые добавляются для облегчения образования аморфной структуры (аморфообразующие элементы). Состав аморфного сплава должен отвечать формуле M80X20 (M – один или несколько металлов, X – один или несколько неметаллов);
сплавы на основе редкоземельных элементов La, Ce, Pr, Nd Gd с 20% атомов металлов нормальной валентности Ag, Au, Cu, Ga, Jn, сильно отличающихся от первых размерами атомов.
Тонкий слой аморфного металла получают при оплавлении поверхностных слоев изделий лазерным лучом благодаря быстрому отводу теплоты основной массой материала детали.
Аморфные сплавы получают не только при сверхскоростном охлаждении жидкого расплава, но и путем высокоскоростого ионно-плазменного и термического распыления материала с последующей конденсацией паров на охлаждаемую жидким азотом подложку.Методом термического распыления в аморфном состоянии получают в основном чистые металлы (Fe, Co, Ni, Mn) в виде тонких пленок толщиной до 1 мкм. Высокоскоростным ионно-плазменным распылением получают аморфные пленки толщиной до 5 мм с высокой производительностью (до 0,02 мкм/с). Этим методом получены аморфные пленки химических составов SmCo2, Sm2Co17, Sm2(Co0,75Fe0,25) и др.
Аморфное состояние сплавов является матастабильным. Поэтому после получения сплавов их подвергают отжигу для достижения равновесного состояния стеклофазы. Обычно максимальная температура отжига для достижения оптимальных физических свойств аморфных сплавов не должна превышать 0,4-0,65 Тпл (Тпл – температура плавления сплава). Нагрев при более высоких температурах, когда тепловая подвижность атомов достигает определённого предела, обычно приводит к кристаллизации аморфной структуры.
Физико-механические свойства аморфных сплавов повышаются благодаря отсутствию кристаллической структуры, межзеренных границ и уменьшению числа дефектов. Аморфные металлические сплавы обладают повышенной прочностью и твердостью с хорошей пластичностью и коррозионной стойкостью. Например, сплав Co34Cr28Mo20C18 имеет твердость HV1150 при прочности 4000 МПа. Аморфные магнитомягкие сплавы на основе железа, железа и никеля, железа и кобальта характеризуются высокой магнитной проницаемостью, малой коэрцитивной силой и высокой прямоугольностью петли гистерезиса; магнитные свойства их малочувствительны к механическим воздействиям. Удельное электрическое сопротивление сплавов в аморфном состоянии в 2-3 раза выше, чем у аналогичных сплавов в кристаллическом состоянии.
Методом катодного распыления получены аморфные пленки из магнитотвердого сплава SmCo5 с магнитной энергией 120 кТл×А/м, которые могут применяться для изготовления магнитотвердых постоянных магнитов. Срок службы аморфных сплавов зависит от температуры эксплуатации. Термическая стойкость их невысока и ограничивается температурой перехода из аморфного состояния в кристаллическое, которое находится в пределах 400-500 °С, хотя имеются сплавы с Ткр > 700 °С, например сплав Ti40Ni40Si20.
1. Какие условия необходимы для протекания процесса кристаллизации?
2. Чем отличается гомогенная кристаллизация от гетерогенной кристаллизации?
3. Как влияет температура переохлаждения расплава на размеры зерен сплавов?
4. При каких условиях охлаждения образуется аморфная структура металлических сплавов?
5. Какие условия необходимо создать для выращивания монокристаллов? Расскажите процесс выращивания полупроводниковых монокристаллов по методу Чохральского.
 2015-05-26
2015-05-26 3840
3840