Кристаллы образованные различными элементами, и имеющие тип решетки, отличные от решеток образующих их элементов называют промежуточными фазами. Из промежуточных фаз наиболее часто встречаются химические соединения.
Химические соединения – фаза постоянного состава, образованная металлами с неметаллами или с элементами проявляющими промежуточные свойства.
Для них характерно простое кратное соотношение элементов, что позволяет выразить их формулой типа АН, ВТ.
Свойства химического соединения резко отличаются от свойств образующих его элементов.
В.№20 Диаграммы фазового равновесия в двухкомпонентной системе: описание, назначение. Понятие фигуративной точки. Правило фаз для определения закономерности изменения числа фаз в гетерогенной системе. Понятие о нонвариантном и моновариантном равновесии.
Атомы в химических соединениях располагаются упорядочено, образование химических соединений сопровождается значительным тепловым эффектом.
Диаграммы фазового равновесия в двухкомпонентных системах.
Процессы кристаллизации и фазовых превращений сплавов описывают с помощью диаграмм фазового равновесия, которые в графическое форме показывают фазовый состав и структуру сплава в зависимости от температуры и концентрации компонентов. Диаграмму строят в координатах температур, концентрации, каждая точка на шкале концентраций соответствует определенному соотношению элементов А и В.
Крайние точки шкалы концентрации соответствуют чистым элементам А и В.
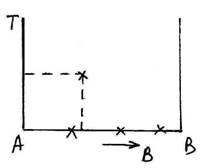
Любая точка на диаграмме состояния характеризует фазы сплава данного состава при данной температуре и называется фигуративной точкой.
Диаграммы состояния позволяют определить фазовый состав в равновесных условиях, т.е. когда все возможные превращения произошли. Это состояние сплава зависит от условий: температура, давление. И характеризуется числом и концентрацией образовавшихся фаз.
Закономерность изменения числа фаз в гетерогенной системе определяется правилом фаз.
Правило фаз – определяет соотношение между числом степеней свободы, числом компонентов и числом фаз, и выражается уравнение: С= К+Р-Ф
где С – число степеней свободы системы,
К – число компонентов
Р - число внешних факторов
Ф – число фаз
Под числом степеней свободы понимают число независимых переменных (температура, давление, концентрация) при изменении которых не изменяется число фаз находящихся в равновесии.
При изучении металлов число внешних факторов давление принимают единицей, учитывая только температуру, т.к. давление мало влияет на фазовый состав, тогда правило фаз: С=К+1-Ф
Р=1
Если число степеней свободы равно 0 система называется конвамантной, при конвамантном равновесии сплав из данного числа фаз может существовать только в совершенного определенных условиях, т.е. при постоянной температуре.
С= 1+1-2=0
Если число степеней свобода равно 1 то равновесие называется моновариантным, если С=2, то бивариантно.
В.№21 Диаграмма состояния системы, в которой компоненты неограниченно растворимы в твердом состоянии. Области на диаграмме состояния. Понятия линии ликвидус и линии солидус. Особенности кристаллизации твердых растворов.
 2015-05-26
2015-05-26 1202
1202








