Вода – слабый электролит, который диссоциирует по уравнению:
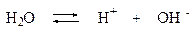
Константа диссоциации воды при 250С составляет:
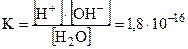
Так как константа диссоциации воды очень мала, можно считать концентрацию воды постоянной величиной:
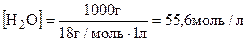
Тогда:
K×[H2O] =[H+] [OH-] = 55,6×1,8×10-16 = 10-14
Kw= [H+] [OH-] = 10-14
Величина Kw называется ионным произведением воды.
Ионное произведение воды характеризует равновесие между ионами водорода и гидроксид-ионами в водных растворах и является постоянной при данной температуре величиной.
Кислотность или основность водного раствора может быть выражена концентрацией ионов водорода или гидроксид-ионов. Чаще всего для этой цели используют величину рН, которая связана с концентрацией ионов водорода следующим соотношением:
pH = - lg[H+]
В нейтральной среде:
[H+] = [OH-] = 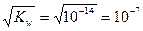 моль/л
моль/л
pH = 7
В кислой среде:
[H+] > [OH-] pH < 7
В щелочной среде:
[H+] <[OH-] pH > 7
 2015-05-26
2015-05-26 1389
1389








