Установлено, что сильные электролиты в растворе полностью распадаются на ионы, т.е. истинное значение a=1. Однако величина степени диссоциации, определяемая по физическим свойствам этих растворов (электропроводность, температура замерзания и т.д.), всегда меньше единицы. Кроме того, к растворам сильных электролитов неприменим закон действия масс в его обычной форме.
Наблюдаемые отклонения в свойствах растворов сильных электролитов связаны с сильным электростатическим взаимодействием ионов в растворе. Каждый ион окружен “ионной атмосферой “ из ионов противоположного знака, которая влияет на его подвижность и вызывает отклонение свойств от ожидаемых величин.
Для характеристики растворов сильных электролитов вместо их истинной концентрации используют активность (a), т.е. условную эффективную концентрацию, в соответствии с которой они проявляют себя в химических и физических процессах:
a = g×c,
где g - коэффициент активности;
с – истинная концентрация.
Коэффициент активности определяется экспериментально и приводится в таблицах. Для разбавленных растворов электролитов g не зависит от природы иона и может быть рассчитан по формуле:
lgg = - 0,5×z2× 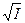 ,
,
где I – ионная сила раствора, которая определяется по формуле:
I = 0,5 (b(X1)z12+ b(X2)z22+ …+b(Xn)zn2)
b(X) - моляльные концентрации ионов
z – заряды ионов.
Для предельно разбавленных растворов, в которых практически отсутствует взаимодействие между ионами, а=с, т.е. g=1.
 2015-05-26
2015-05-26 1314
1314
