Растворы электролитов. Слабые электролиты. Закон разбавления Оствальда
Электролиты – это вещества, растворы которых проводят электрический ток посредством ионов, на которые они распадаются под действием полярных молекул растворителя.
По типу диссоциации электролиты разделяют на кислоты, основания, амфотерные гидроксиды и соли.
Количественной характеристикой диссоциации электролита является степень диссоциации a, которая равна отношению числа продиссоциировавших молекул к общему числу молекул:
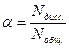 |
По степени диссоциации различают сильные электролиты (a>30%), слабые электролиты (a<3%) и электролиты средней силы (3% <a<30%).
Степень диссоциации не является строгой характеристикой электролита, так как зависит не только от его природы, но и от концентрации, и увеличивается при разбавлении раствора.
Растворы слабых электролитов
Диссоциация слабых электролитов – обратимый процесс, к которому применим закон действия масс:
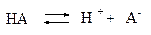
Константу равновесия процесса диссоциации называют константой диссоциации.
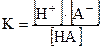
Если диссоциация протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой:
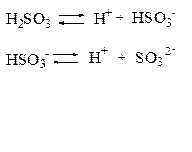 |
1-ая ступень:
2-ая ступень:
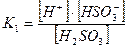 | 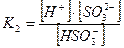 |
При этом К1>К2 , а Ксум=К1×К2.
Константа диссоциации, как и любая константа равновесия, не зависит от концентрации и является строгой характеристикой электролита при данной температуре. Для слабых электролитов Кдисс< 10-4.
Зависимость константы диссоциации от температуры определяется знаком теплового эффекта процесса диссоциации.
Рассмотрим процесс диссоциации слабого электролита HA с концентрацией c и степенью диссоциации a:
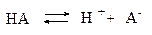
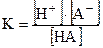
Cогласно уравнению диссоциации:
[H+] = [A-] =ac.
Тогда
[HA] = (1-a) c.
После подстановки полученных выражений в уравнение для константы диссоциации получим:
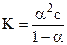
Так как a<<1, то ее величиной в знаменателе можно пренебречь:
К=a2с
или
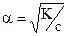
Полученное соотношение является математическим выражением закона разбавления Оствальда:
Степень диссоциации электролита возрастает при разбавлении раствора.
 2015-05-26
2015-05-26 5085
5085








