| 61. в соответствии с теорией бренстеда ион | является | |
| 1) NH4+ 2) Cl- 3) HCO3- | А. кислотой Б. основанием В. амфолитом Г. электрофилом Д. нуклеофилом Е. карбоанионом |
| 62. в соответствии с теорией бренстеда ион | является | |
| 1) H3O+ 2) CH3COO- 3) HSO3- | А. кислотой Б. основанием В. амфолитом Г. гидрид-ионом Д. алкоксид-ионом Е. сульфониевым |
| 63. в соответствии с теорией бренстеда ион | является | |
| 1) CH3NH3+ 2) PO43- 3) HSO3- | А. основанием Б. фосфониевым В. кислотой Г. амфолитом Д. сульфониевым Е. нитрониевым |
64. Если кислота характеризуется значением 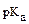 равным равным | то в данном ряду она является | |
| 1) 4 2) 6 3) 10 | А. самой сильной Б. самой слабой В. промежуточной силы Г. одноосновной Д. двухосновной Е. многоосновной |
| 65. в соответствии с теорией бренстеда ион | является | |
| 1) C2H5NH3+ 2) HS- 3) CN- | А. амфолитом Б. сульфониевым В. основанием Г. кислотой Д. нитрониевым Е. карбениевым |
66. Если кислота характеризуется значением 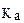 равным равным | то в данном ряду она является | |
| 1) 10-4 2) 10-8 3) 10-10 | А. промежуточной силы Б. самой слабой В. самой сильной Г. одноосновной Д. двухосновной Е. многоосновной |
| 67. в соответствии с теорией Бренстеда в реакции | вода | |
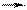 1) CO32- + H2O HCO3- + OH- 1) CO32- + H2O HCO3- + OH- 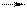 2) NH4+ + H2O NH3 + H3O+ 2) NH4+ + H2O NH3 + H3O+ 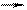 3) 2H2O H3O+ + OH- 3) 2H2O H3O+ + OH- | А. является кислотой Б. катализирует процесс протонирования В. является амфолитом Г. ингибирует процесс протонирования Д. является основанием Е. не влияет на скорость протонирования |
| 68. формула для расчета | имеет вид | |
| 1) ионной силы раствора 2) коэффициента активности ионов сильного электролита 3) степени диссоциации слабого электролита | А. 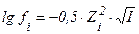 Б. Б. 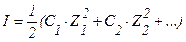 В. В. 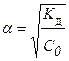 Г. Г. 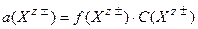 Д. Д. 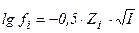 Е. Е. 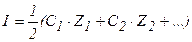 |
| 69. в растворах KCl с ионной силой, равной (моль/л) | коэффициент активности иона K+ можно оценить как | |
| 1) 0,1 2) 0,2 3) 0,3 | А. самый низкий Б. промежуточный В. самый высокий Г. равный 0 Д. равный 1 Е. > 1 |
| 70. в растворах KCl с ионной силой, равной (моль/л) | коэффициент активности иона K+ можно оценить как | |
| 1) 0,1 2) 0,5 3) 0,8 | А. самый низкий Б. промежуточный В. самый высокий Г. равный 0 Д. равный 1 Е. > 1 |
| 71. если в одинаковых растворах HF содержится KF в количестве (моль) | то степень диссоциации HF в растворе можно оценить как | |
| 1) 0,05 2) 0,25 3) 0,5 | А. самую низкую Б. самую высокую В. промежуточную Г. равную 0 Д. равную 50% Е. равную 100% |
| 72. в растворе уксусной кислоты (T = const) с концентрацией (моль/л) | степень диссоциации кислоты можно оценить как | |
| 1) 0,1 2) 0,5 3) 0,9 | А. самую низкую Б. самую высокую В. промежуточную Г. равную 0 Д. равную 50% Е. равную 100% |
| 73. величина | при разбавлении раствора (t = const) | |
| 1) степени диссоциации 2) константы диссоциации 3) активности электролита | А. уменьшается Б. увеличивается В. не изменяется Г. может как уменьшаться, так и увеличиваться Д. теряет физический смысл Е. девальвируется |
| 74. в соответствии с теорией бренстеда ион | является | |
| 1) NH2 - NH3+ 2) RCOO- 3) H3O+ | А. кислотой Б. гидрид-ионом В. амфолитом Г. основанием Д. карбонилом Е. алкиламмониевым |
| 75. если в одинаковых растворах HNO2 содержится KNO2 в количестве (В моль) | то степень диссоциации HNO2 в растворе можно оценить как | |
| 1) 0,1 2) 0,4 3) 0,8 | А. самую высокую Б. самую низкую В. промежуточную Г. равную 0 Д. равную 50% Е. равную 100% |
 2015-05-26
2015-05-26 1263
1263
