В изолированных атомах электроны занимают вполне определенные энергетические уровни, т.е. изолированный атом характеризуется дискретным энергетическим спектром. Часть разрешенных энергетических уровней в атоме заполнена, а другая часть заполняется при внешних энергетических воздействиях, приводящих атом в возбужденное состояние. Такое распределение электронов на уровне атома сохраняется, если в системе из N одинаковых атомов отсутствует взаимодействие между ними (к примеру, разряженный газ).
При конденсации такой разряженной системы в жидкость с последующей кристаллизацией, в образовавшемся твердом теле происходит обменное взаимодействие между атомами. Последнее выражается в перекрытии электронных оболочек атомов, которое в свою очередь существенно изменяет характер движения электронов, так как, благодаря такому перекрытию оболочек электроны могут без изменения энергии, посредством, обмена переходить от атома к атому.
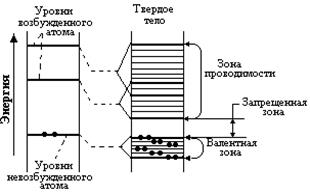
В результате обменного взаимодействия дискретные энергетические уровни изолированного атома расщепляются, образуя энергетические зоны, как это схематически показано для полупроводников и диэлектриков на рис.2.1
а) б)
Рис. 2.1 Схема перехода энергетических уровней: а -изолированного атома; б -твердое тело (полупроводник, диэлектрик)
Ширина разрешенных энергетических зон не зависит от размеров кристалла, а определяется природой атомов, образующих твердое тело и симметрией кристаллической решетки.
Для системы, содержащей N - атомов, каждый из которых имеет в решетке Z ближайших соседей, энергия обменного взаимодействия может быть определена, как
WА=N×Z×A×f(s)2, (1.2.5)
где А - обменный интеграл для соседних атомов; f(s)- вероятность того, что электроны будут иметь параллельную ориентацию спинов. К примеру, если энергия обменного взаимодействия между двумя атомами равна WА, тогда для кристаллов с простой кубической решеткой, где каждый атом имеет шесть ближайших соседей, расщепление уровней в зоны составит 12WА, соответственно для ГЦК и ОЦК решеток 24 WА и 16 WА. Поскольку обменная энергия WА зависит от степени перекрытия электронных оболочек, то уровни энергии внутренних оболочек, которые локализованы вблизи ядра, расщепляются меньше, чем уровни валентных электронов.
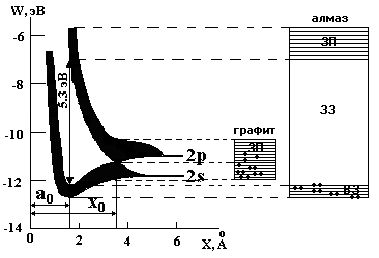
Рис.2.2 Схема образования зон при взаимодействии атомов
углерода(ао и хо- равновесные расстояния между атомами, соответственно в алмазе и графите)
В зонах разрешенных энергетических состояний дискретные уровни располагаются друг от друга по энергии в среднем на 10-22 – 10-23 эВ. Последнее дает возможность считать зону квазинепрерывной, поскольку для перехода электрона с уровня на уровень требуется ничтожно малое энергетическое воздействие, т.е. электрон может квазисвободно перемешаться по зоне. В качестве примера, приведем схему образования энергетических зон при сближении атомов углерода(см. рис.2.2).
Подобно энергетическим уровням в изолированных атомах, энергетические зоны могут быть полностью заполненными, либо частично заполненными или свободными. Самая верхняя из заполненных электронами зон называется валентной зоной (ВЗ). Данная зона формируется из расщепленных энергетических уровней, отвечающих внешней электронной оболочки в изолированных атомах. Ближайшую к ней свободную незаполненную зону называют зоной проводимости (ЗП). Взаимное расположение этих зон определяет специфику большинства процессов и явлений, протекающих в твердых телах. В металлах и металлических сплавах валентная зона перекрывается с зоной проводимости. В полупроводниках и диэлектриках валентная зона и зона проводимости разделены энергетической зоной (запрещенная зона - ЗЗ), в пределах которой отсутствуют разрешенные электронные состояния. Схематически зонные диаграммы для различных материалов представлены ниже на рис. 2.3.
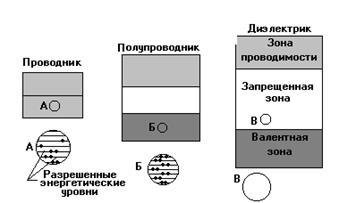
Рис. 2.3 Схематическое представление строения энергетических зон в различных материалах.
 2015-05-26
2015-05-26 4213
4213
