1. математическое выражение закона Дебая-хюккеля имеет вид
1) 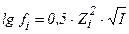
2) 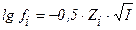
3) 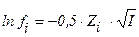
4) 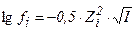
5) 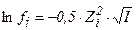
 2. в реакции Ag+ + 2NH3 [Ag(NH3)2]+ с позиций теории льюиса ион Ag+ является
2. в реакции Ag+ + 2NH3 [Ag(NH3)2]+ с позиций теории льюиса ион Ag+ является
1) анионом
2) кислотой
3) основанием
4) окислителем
5) восстановителем
3. Из перечисленных оснований самым слабым является
1) F-
2) S2-
3) NO2-
4) NO3-
5) CN-
 4. в реакции NH4+ + H2O NH3 + H3O+ ион NH4+ с позиций теории бренстеда является
4. в реакции NH4+ + H2O NH3 + H3O+ ион NH4+ с позиций теории бренстеда является
1) кислотой
2) анионом
3) акцептором электронной пары
4) донором электронной пары
5) основанием
5. при переходе к растворителю с большей диэлектричес-кой проницаемостью степень диссоциации электролита
1) уменьшается
2) не изменяется
3) может как уменьшаться, так и увеличиваться
4) увеличивается
5) становится равной нулю, т.к. диссоциация прекращается
 6. в реакции 2Ag+ + S2- Ag2S ион Ag+ с позиций теории льюиса является
6. в реакции 2Ag+ + S2- Ag2S ион Ag+ с позиций теории льюиса является
1) анионом
2) кислотой
3) основанием
4) окислителем
5) восстановителем
7. среди представленных щелочей самым слабым основанием является
1) NaOH
2) KOH
3) NH3∙H2O
4) Ca(OH)2
5) LiOH
 8. в реакции протонирования H2O + H+ H3O+ молекула H2O с позиций теории Бренстеда является
8. в реакции протонирования H2O + H+ H3O+ молекула H2O с позиций теории Бренстеда является
1) акцептором электронной пары
2) сольватирующим агентом
3) основанием
4) кислотой
5) амфолитом
9. Из перечисленных оснований самым сильным является
1) SO42-
2) SO32-
3) Cl-
4) ClO4-
5) NO3-
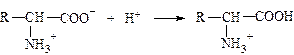
10. в реакции
молекула белка с позиций теории льюиса является
1) акцептором электронной пары
2) донором протонов
3) основанием
4) кислотой
5) амфолитом
11. при увеличении ионной силы раствора коэффициенты активности ионов
1) возрастают для анионов, снижаются для катионов
2) снижаются для анионов, возрастают для катионов
3) не изменяются
4) возрастают независимо от заряда иона
5) снижаются независимо от заряда иона
 12. в реакции HSO3- + OH- SO32- + H2O с позиций теории Бренстеда молекула H2O по отношению к иону OH- является
12. в реакции HSO3- + OH- SO32- + H2O с позиций теории Бренстеда молекула H2O по отношению к иону OH- является
1) кислотой
2) основанием
3) сопряженной кислотой
4) сопряженным основанием
5) амфолитом
13. понятию «коэффициент активности» соответствует определение
1) отношение числа активных соударений ионов к общему числу ионов в растворе
2) отношение скоростей движения ионов в растворе в зави-симости от их заряда
3) отклонение поведения ионов в растворе от их поведения в растворе при бесконечном разбавлении
4) отклонение скоростей диффузии ионов от «идеальной» скорости при отсутствии межионных взаимодействий
5) отношение массы свободного иона к массе сольватирован-ного иона
 14. в реакции H2N - NH2 + H+ H2N - NH3+ молекула гидразина с позиций теории льюиса является
14. в реакции H2N - NH2 + H+ H2N - NH3+ молекула гидразина с позиций теории льюиса является
1) электроноакцептором
2) кислотой
3) амфолитом
4) основанием
5) сольватирующим агентом
15. понятию «активность иона» соответствует определение
1) максимальная скорость движения иона в электрическом поле
2) отношение скорости движения иона в растворе к скорости в вакууме
3) концентрация иона, в соответствии с которой он участвует в ионных взаимодействиях
4) эффективная концентрация иона, в соответствии с которой он участвует в различных процессах
5) скорость движения иона в броуновском движении
 16. в реакции C6H5COOH + NH3 C6H5COO- + NH4+ с позиций теории Бренстеда молекула NH3 по отношению к иону NH4+ является
16. в реакции C6H5COOH + NH3 C6H5COO- + NH4+ с позиций теории Бренстеда молекула NH3 по отношению к иону NH4+ является
1) кислотой
2) основанием
3) сопряженной кислотой
4) сопряженным основанием
5) амфолитом
17. понятию «ионная сила» соответствует определение
1) сумма произведений концентраций ионов на их заряд
2) полусумма произведений концентраций ионов на их заряд
3) полусумма произведений квадрата концентраций ионов на их заряд
4) полусумма произведений концентраций ионов на квадрат их заряда
5) полусумма произведений квадратов концентраций ионов на квадрат их заряда
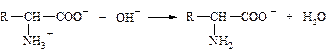
18. в реакции
молекула белка с позиций теории бренстеда является
1) акцептором электронной пары
2) донором электронной пары
3) основанием
4) кислотой
5) амфолитом
19. сила кислот HCN (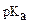 = 9,14), CH3COOH (
= 9,14), CH3COOH (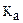 = 1,8∙10-5), HClo (
= 1,8∙10-5), HClo (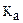 = 8∙10-9), H2CO3 (
= 8∙10-9), H2CO3 (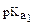 = 6,2) убывает в ряду
= 6,2) убывает в ряду
1) CH3COOH > HClo > H2CO3 > HCN
2) HClo > HCN > CH3COOH > H2CO3
3) CH3COOH > H2CO3 > HCN > HClo
4) CH3COOH > H2CO3 > HClo > HCN
5) H2CO3 > CH3COOH > HClo > HCN
20. согласно теории Льюиса кислотой является частица
1) образующуя при диссоциации ион H+
2) имеющая неспаренный электрон
3) способная принимать электронную пару
4) обладающая повышенной электронной плотностью
5) проявляющая парамагнитные свойства
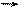 21. в реакции диссоциации NaI + (x + y)H2O [Na(H2O)x]+ + [I(H2O)y]-, молекулы H2O проявляют свойства
21. в реакции диссоциации NaI + (x + y)H2O [Na(H2O)x]+ + [I(H2O)y]-, молекулы H2O проявляют свойства
1) комплексообразователя
2) основания
3) кислоты
4) амфолита
5) сильного электролита
22. сила одноосновных кислот HX (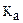 = 10-5), HY (
= 10-5), HY (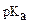 = 4,6), HZ (
= 4,6), HZ (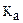 = 3,6∙10-3), возрастает в ряду
= 3,6∙10-3), возрастает в ряду
1) HY < HZ < HX
2) HY < HX < HZ
3) HX < HY < HZ
4) HZ < HX < HY
5) HX < HZ < HY
23. согласно теории Льюиса основанием является частица
1) образующая при диссоциации ион OH-
2) обладающая свободной электронной орбиталью для образования ковалентной связи
3) способная отдавать электронную пару для образования ковалентной связи
4) обладающая повышенной электрофильностью
5) обладающая повышенной подвижностью в водных растворах
 24. в реакции H2N - NH3+ + H2O H2N - NH2 + H3O+ ион гидразиния с позиций теории бренстеда является
24. в реакции H2N - NH3+ + H2O H2N - NH2 + H3O+ ион гидразиния с позиций теории бренстеда является
1) кислотой
2) основанием
3) амфолитом
4) электроноакцептором
5) электронодонором
25. согласно теории бренстеда основанием является частица
1) обладающая пониженной подвижностью в растворах
2) способная присоединять протон
3) имеющая свободную орбиталь
4) образующая при диссоциации ион OH-
5) обладающая повышенной электрофильностью
 26. согласно теории льюиса процесс BF3 + NH3 BF3∙NH3 является реакцией
26. согласно теории льюиса процесс BF3 + NH3 BF3∙NH3 является реакцией
1) моляризации
2) сольволиза
3) нейтрализации
4) замещения
5) диссоциации
27. закон разведения оствальда в математической форме имеет вид
1) 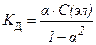
2) 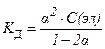
3) 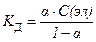
4) 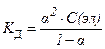
5) 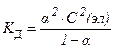
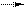 28. согласно теории льюиса в реакции AlCl3 + Cl- [AlCl4]- ион Cl- является
28. согласно теории льюиса в реакции AlCl3 + Cl- [AlCl4]- ион Cl- является
1) катионом
2) окислителем
3) кислотой
4) восстановителем
5) основанием
29. понятию «константа диссоциации» соответствует определение
1) отношение числа распавшихся молекул к общему числу молекул в растворе
2) отношение числа продиссоциировавших молекул к числу молекул, не подвергшихся диссоциации
3) отношение концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части молекул
4) стехиометрическое отношение концентраций катионов и анионов образовавшихся в результате диссоциации
5) стехиометрическое отношение произведения концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части электролита
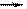 30. согласно теории льюиса в реакции BF3 + F- [BF4]- молекула BF3 является
30. согласно теории льюиса в реакции BF3 + F- [BF4]- молекула BF3 является
1) основанием
2) нуклеофилом
3) кислотой
4) комплексообразователем
5) сопряженным основанием
31. понятию «степень диссоциации» соответствует определение
1) стехиометрическое отношение концентраций образовавшихся ионов
2) отношение концентрации анионов к концентрации недиссоциированной части молекул
3) отношение числа диссоциированных молекул к числу недиссоциированных молекул
4) отношение числа диссоциированных молекул к общему числу молекул растворенного вещества
5) отношение числа недиссоциированных молекул к числу молекул, подвергшихся диссоциации
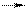 32. согласно теории Бренстеда в реакции H3O+ H+ + H2O молекула H2O по отношению к иону гидроксония является
32. согласно теории Бренстеда в реакции H3O+ H+ + H2O молекула H2O по отношению к иону гидроксония является
1) акцептором электронной пары
2) электрофилом
3) кислотой
4) сопряженной кислотой
5) сопряженным основанием
 2015-05-26
2015-05-26 2199
2199