Ионы Н+ в растворе определяют кислую среду.
1. Растворы кислот изменяют окраску индикаторов:
Лакмус: красный,
Метилоранж: розовый.
1. Разбавленные кислоты реагируют с металлами, стоящими слева от водорода в ряду напряжения металлов с образованием соли и водорода, например, при взаимодействии серной кислоты с цинком образуются сульфат цинка и водород:
Zn + H2SO4 = ZnSO4 + H2
1. Растворы кислот взаимодействуют с основными оксидами с образованием соли и воды, например, при взаимодействии серной кислоты с оксидом меди(II) образуются сульфат меди(II) и вода:
H2SO4 + CuO = CuSO4 + H2O
1. Все кислоты взаимодействуют с основаниями с образованием соли и воды, например: при взаимодействии серной кислоты с гидроксидом натрия образуются сульфат натрия и вода:
2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
2OH- + 2H+ = 2H2O.
Гидроксид меди(II) растворяется в серной кислоте с образованием сульфата меди(II) и воды:
Cu(OH)2 + H2SO4 = Cu SO4 + 2H2O
Cu(OH)2 + 2H+ + SO42- = Cu2+ + SO42- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
Кислоты вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца (выпадает осадок или выделяется газ), например: при взаимодействии соляной кислоты с раствором карбоната натрия выделяется углекислый газ и образуется вода:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
Реакция протекает за счёт связывания катионов водорода и карбонат-ионов.
2. 6. На металлический магний подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния
Дано:(Mg)
m (р-р HCl) = 100 г,
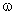 (HCl) = 30%.
(HCl) = 30%.
Найти: m (MgCl2). Не решено
Билет№9:
Основания – это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания – это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы.
NaOH ® Na+ + OH-
Ca(OH)2 ® CaOH+ + OH- ® Ca2+ + 2OH- -
Существует несколько признаков классификации оснований:
1. В зависимости от растворимости в воде основания делят на щёлочи (расворимые в воде) и нерастворимые в воде. Щелочами являются гидроксиды щелочных металлов (Li, Na, K, Rb, Cs) и щелочноземельных металлов (Ca, Sr, Ba). Все остальные основания являются нерастворимыми:Mg(OH)2,Сu(OH)2,Al(OH)3,Cr(OH)3
2. В зависимости от степени диссоциации основания делятся на сильныеэлектролиты (все щёлочи) и слабыеэлектролиты (нерастворимые основания).
3. В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные (1 группа ОН), например, гидроксид натрия, гидроксид калия, двухкислотные (2 группы ОН), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
 2015-05-30
2015-05-30 1028
1028