Желтый железооксидный пигмент по химической природе является гидратом оксида железа состава FeO(ОH) или Fe2O3×H2O. Моногидрат оксида железа (III) может кристаллизоваться в трех кристаллических модификациях: a-FeO(OH) (гетит), метастабильная b-FeO(OH) и g-FeO(OH) (лепидокрокит). В качестве пигмента применяется, главным образом, гетит.
Моногидрат оксида железа (III) не растворяется в воде и уксусной кислоте. Обладая амфотерными свойствами, легко растворяется в неорганических кислотах и заметно растворяется в горячих концентрированных растворах КОН или NаОН, образуя при этом ферраты калия и натрия — KFeO2 и NaFeO2. Дегидратация пигмента происходит при 200 °С, при этом изменяются его оптические свойства. При 220 °С резко усиливается красный оттенок.
Желтый железооксидный пигмент обладает высокими пигментными свойствами. Он отличается высокой укрывистостью и красящей способностью, атмосферостоек и светостоек. Может применяться для эмалей и красок на основе любых пленкообразователей, предназначенным для получения покрытий, эксплуатируемых как внутри помещений, так и в атмосферных условиях. Кроме того пигмент используется в рези новой промышленности, а также в качестве сырья для синтеза красного железооксидного пигмента.
Обычно выпускается несколько марок желтого железооксидного пигмента, различающихся главным образом по цвету, содержанию основного вещества и по дисперсности. Лучшие сорта желтого железо оксидного пигмента имеют цвет, соответствующий следующим значениям координат цвета: Х = 36,0 - 41,0; Y = 33,1 - 40,0; Z = 9,0 - 13,0
Пигмент содержит обычно до 1—1,5% SO3 и водная вытяжка его по этой причине имеет рН < 7. Наличие SO3 ограничивает применение пигмента в водоразбавляемых лакокрасочных материалах. Свойства желтого железооксидного пигмента приведены в табл. 2.5.
Желтый железооксидный пигмент получают обычно в результате гидролиза ионов Fe3+ в кислой среде, которые образуются в растворе при окислении ионов Fe2+ кислородом воздуха. Ионы Fe2+ и Fe3+ в водных растворах обычно гидролизованы. Гидролиз идет через стадию образования оксокислот [Fe(H2O)6]2+ для Fe2+ и [Fe(H2O)6]з+ для Fe3+. Кислотность среды при гидролизе повышается за счет диссоциации этих кислот:
[Fe(H2O)6]2+ 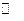 [Fe(H2O)5OH]+ + H+,
[Fe(H2O)5OH]+ + H+,
[Fe(H2O)6]3+ 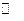 [Fe(H2O)5OH]2+ + H+.
[Fe(H2O)5OH]2+ + H+.
Константа гидролиза ионов Fe3+ значительно выше константы гидролиза ионов Fe2+ вследствие большего заряда центрального атома в комплексе.
Гидролиз ионов Fe3+ при повышении рН проходит через ряд последовательных стадий:
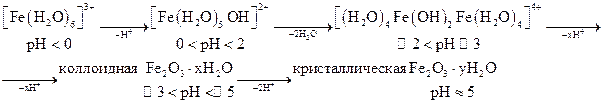
Продукт гидролиза [(Н2O)4Fе(ОН)2Fе(Н2O)4]4+ представляет собой димер, связанный посредством гидроксо-мостиков:
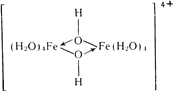
Непосредственным осаждением гидрата оксида железа (III) из растворов Fe3+ получить продукт, обладающий пигментными свойствами не удается, так как он неизбежно образуется в виде коллоидного осадка, поэтому процесс проводят в растворе солей железа (II), осуществляя гидролиз ионов Fe2+, получающихся при окислении кислородом воздуха ионов Fe2+:
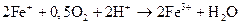
При повышении рН скорость окисления увеличивается, несмотря на то, что потенциал окислительной реакции становится более отрицательным. Это объясняют чисто кинетическими причинами, так как ионы Fe2+ и Fe3+ находятся в растворе в виде комплексов с водой и ионе ОН-, а также промежуточными процессами образования пероксидных и гидропероксидных ионов FeO2+ и FeOOH2+ кинетика процесса определяется промежуточными реакциями.
Регулирование при осаждении рН, от значения которого зависят многие свойства получаемого пигмента, проводится путем введения нейтрализующего агента, в качестве которого используют аммиак или, чаще всего, железо в виде металлического лома. В этом случае суммарная реакция образования желтого железооксидного пигмента соответствует следующему уравнению:
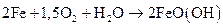 .
.
Для исключения образования коллоидного гидроксида железа синтез проводят в присутствии зародышей, которыми служит гидроксид железа (III), полученный окислением гидроксида железа (II), обычно осаждаемого аммиаком:
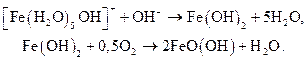
Цвет желтых железооксидных пигментов зависит от размера частиц. Пигмент с частицами менее 0,2 мкм имеет блекло-желтый цвет с зеленоватым оттенком, с частицами 0,3 - 0,4 мкм — ярко-желтый, с частицами 0,5 - 0,8 мкм — желтый, обладающий наивысшей красящей способностью. Пигмент с частицами более 2 мкм имеет темно-желтый цвет с красноватым оттенком. Для получения пигмента с частицам оптимального размера (0,4 - 0,6 мкм) вводят зародыши в количестве 8 - 10% от массы пигмента, которые осаждают при температуре не выше 20 °С.
Зародыши готовят в отдельных реакторах или в реакторах синтез пигмента, куда затем погружают железные стружки или обрезь и заливают раствор сульфата железа (II). Через реакционную массу продувают воздух в течение 2—3 суток. Раствор сульфата железа, в сред которого происходит синтез пигмента, практически не расходуется, н загрязняется примесями, имеющимися в железе, и ионами аммония, вводимыми с суспензией зародышей. Поэтому весь раствор или его часть обновляется в каждом цикле периодически осуществляемого процесса синтеза. Раствор сульфата железа, отделенный фильтрование от полученного пигмента, окисляют кислородом воздуха при температуре 60 - 70 °С и нейтрализуют до рН = 7,5. Высажденный темно-желтый осадок также используется в качестве пигмента.
Промывные воды освобождаются от ионов железа и сульфат-ионов нейтрализацией гидроксидом кальция с одновременной продувкой воздуха. Образуется гипс, окрашенный гидроксидом железа (III), который используется в строительных материалах.
Красный железооксидный пигмент. По химическому составу красны железооксидный пигмент — это оксид железа (III) Fе2O3 гексагональной системы (гематит).
Свойства красного железооксндного пигмента представлены в табл. 2.5. Пигмент светостоек и атмосферостоек. Применяется для получения грунтовок, эмалей и красок на основе любых пленкообразователей. Используется для окрашивания резины, пластмасс, древесностружечных материалов. Цвет пигмента в зависимости от размера частиц изменяется от оранжево-красного до пурпурного. Размер части оранжево-красного пигмента 0,2 - 0,4 мкм, красного — 0,4 - 0,6 мкм малиново-красного — 1 - 1,5 мкм, пурпурного — 2 - 3 мкм.
Красный железооксидный пигмент получают чаще всего термические разложением железного купороса с предварительной его дегидратацией до одноводного сульфата во избежание спекания конечного продукта:
2FeSO4×H2О 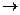 Fе2O3 + SO2 + SO3 + 2H2O.
Fе2O3 + SO2 + SO3 + 2H2O.
При температуре 700 - 725 °С получается красно-оранжевый пигмент, при температуре 730 - 780 °С - красный, при температуре 850 °С - пурпурно-фиолетовый.
Получают красный железооксидный пигмент и дегидратацией желтого:
Используется для получения красного железооксидного пигмент и осадочный способ, аналогичный способу получения желтого. Основное отличие заключается в методе синтеза зародышей, которые получают при рН > 11. Синтез пигмента проводится в присутствии солей алюминия и цинка. Назначение этих солей — предотвращение взаимодействия гидроксидов железа в разных степенях окисления и образования черного смешанного оксида железа Fе3O4.
 2015-05-30
2015-05-30 1765
1765








