• Микробиологическая диагностика инфекций, вызванных энтеровирусами (полиовирусы, вирусы Коксаки и ECHO)
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: смывы из зева (первые дни болезни), фекалии; спинномозговая жидкость (при менингите).
МЕТОДЫ ДИАГНОСТИКИ:
Вирусологическое исследование. Является ведущим методом диагностики энтеровирусных инфекций. Выделение энтерови-русов (за исключением вирусов Коксаки типа А) из исследуемого материала осуществляют путем заражения клеточных культур. Для уничтожения сопутствующей бактериальной микрофлоры нестерильный материал (испражнения, глоточные смывы) предварительно обрабатывают антибиотиками (смесь пенициллина со стрептомицином, содержащая по 1000 ЕД/мл каждого антибиотика в растворе Хенкса) в течение суток при 4 °С, после чего проводят контрольный посев на стерильность. При сохранении бактериальной флоры материал повторно обрабатывают теми же антибиотиками. Затем одновременно заражают по 2—3 пробирки с первичной (эмбриональные фиб-робласты человека или клетки почек обезьян) и перевиваемой культурой клеток (HeLa, амниона человека или др.), поскольку одни серотипы энтеровирусов лучше репродуцируются в первичных, другие — в перевиваемых клетках.
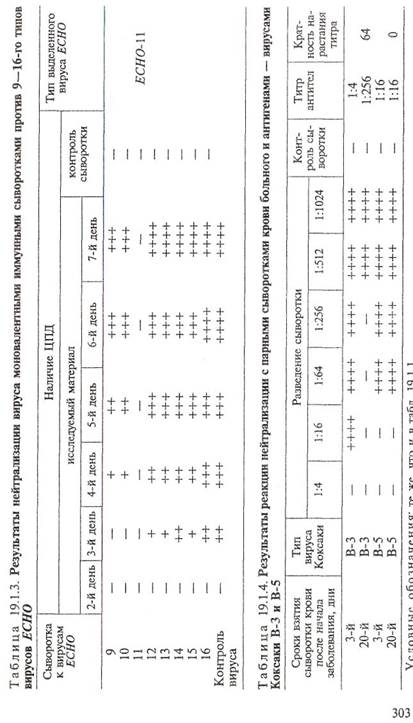
Индикацию вирусов проводят по ЦПД: на 2—3-й день инкубации при 35 °С наблюдается полная или частичная дегенерация клеток. При этом интенсивность ЦПД зависит от дозы вируса, типа культуры клеток и других причин. В случае отсутствия ЦПД проводят дополнительно 2—3 пассажа. Основным методом идентификации выделенного вируса является серотипирование в реакции нейтрализации (табл. 19.1.1; 19.1.2; 19.1.3). С этой целью материал из чистой культуры выделенного вируса обрабатывают смесью диагностических моновалентных сывороток к различным серотипам энтеровирусов. При нейтрализации вируса в последующих пересевах ЦПД исчезает. Затем проводят реакцию нейтрализации с моновалентными сыворотками. При этом в начале определяют тип вируса (полиовирус, Коксаки или ECHO), а затем его принадлежность к определенному серотипу.
Таблица 19.1.1. Результаты реакции нейтрализации выделенных от больных вирусов с моновалентными иммунными сыворотками к вирусам полиомиелита I—III типов
| Сыворотка к вирусам полиомие- | Наличие ЦПД | Тип выделенного вируса | ||||||
| исследуемый материал | контроль сыво- | |||||||
| 2-й | 3-й | 4-й | 5-й | 6-й | 7-й | миелита | ||
| день | день | день | день | день | день | ротки | ||
| I II — — + +++ ++++ | ++++ | I | ||||||
| III — — ++ +++ ++++ | ++++ | — | ||||||
| Контроль — + ++ +++ ++++ | ++++ | |||||||
| вируса |
Условные обозначения: (++++) —выраженная дегенерация клеток с их отслаиванием от стенок пробирки; (+++) — менее выраженная дегенерация клеток с частичным отслаиванием от стенок пробирки; (+.+) — наличие не более 50 % дегенерированных клеток; (+) — наличие одиночных дегенерированных клеток; (—) — отсутствие ЦПД.
Таблица 19.1.2. Результаты реакции нейтрализации вьщеленных от больных вирусов с моновалентными иммунными сыворотками к вирусам Коксаки
| Сыворот- | Наличие ЦПД | Тип | ||||||
| сам Коксаки | исследуемый материал | контроль сыворотки | го вируса Коксаки | |||||
| 2-й день | 3-й день | 4-й день | 5-й день | 6-й день | 7-й день | |||
| В-1 | — | + + | +++ | ++++ | ++++ | — | ||
| В-2 | — | ++ +++ | +++ | ++++ | ++++ | — | ||
| В-3 | — | — — | — | — | — | — | Коксаки В-3 | |
| В-4 | — | + + + | +++ | ++++ | +++ + | __ | ||
| В-5 | — | ++ + + | +++ | ++++ | + + + + | — | ||
| В-6 | — | + ++ | +++ | ++++ | ++ + + | — | ||
| Контроль вируса | — | ++ +-Н- | +++ | ++++ | +++ + | — | ||
Условные обозначения: те же, что и в табл. 19.1.1.
Некоторые энтеровирусы (вирусы ECHO серотипов 3, 6, 7; Коксаки А серотипов 20 и 21; Коксаки В серотипов 1 и 5) обладают гемагглютинирующими свойствами. Их идентифицируют в РТГА. Для идентификации применяют и другие методы (ИФ, ИФА, метод ДНК-зондов и др.).
 |  | ||
 |
Необходимо помнить, что положительный результат вирусологического исследования имеет абсолютную диагностическую ценность только в случае выделения вируса из стерильного материала (спинномозговая жидкость, кровь, биоптаты органов), поскольку бессимптомное носительство широко распространено (до 50 % здорового населения). При обнаружении вируса в испражнениях или глоточных смывах необходимо серологическое подтверждение диагноза.
Биопроба. Для выделения вирусов Коксаки А, которые плохо репродуцируются в культурах клеток, применяют биопробу — исследуемым материалом заражают новорожденных белых мышей. В положительном случае у зараженных животных на 3—5-й день развиваются вялые параличи. Идентификацию этих вирусов проводят в РН на новорожденных мышах с моновалентными диагностическими сыворотками против различных серотипов вирусов Коксаки А.
Экспресс-методы диагностики. Молекулярно-биологи-ческие исследования. РНК вирусов в исследуемом материале обнаруживают методом гибридизации НК (ДНК-зондов).
Серодиагностика. С диагностической целью в крови больных определяют наличие специфических противовирусных иммуноглобулинов класса М (IgM) с помощью ИФА. Для ретроспективного подтверждения диагноза применяют также метод парных сывороток. С этой целью кровь у больного берут дважды: в первые дни болезни и через 3—4 нед. Раннюю сыворотку сохраняют в холодильнике и реакцию ставят одновременно с обеими сыворотками. Антитела определяют в реакции нейтрализации в культуре клеток с эталонными штаммами энтеровирусов, принадлежащих к тем серотипам, которые чаще всего выделяют от больных (табл. 19.1.4). Для серодиагностики заболеваний, вызванных гемагглютинирующими вирусами Коксаки, используют РТГА. Диагностическое значение имеет нарастание титра антител в поздней сыворотке не менее чем в 4 раза. При обнаружении антител, соответствующих серотипу выделенного вируса, диагноз считается подтвержденным.
• Микробиологическая диагностика весенне-летнего клещевого энцефалита
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Серодиагностика. Обнаружение противовирусных антител в крови больного является основным методом диагностики клещевого энцефалита, поскольку к моменту появления симптомов заболевания период вирусемии заканчивается. Выделение вируса из спинномозговой жидкости редко бывает успешным. Для серодиагностики применяют метод парных сывороток. Используют РН, РСК, РТГА, реакцию латекс-агглютинации, ИФА и другие
 реакции со стандартными вирусными антигенами. Диагностическое значение имеет нарастание титра специфических антител не менее чем в 4 раза. Оценку результатов производят с учетом анамнестических данных: вакцинация, пассивная иммунизация (введение противоэнцефалитной сыворотки или иммуноглобулина).
реакции со стандартными вирусными антигенами. Диагностическое значение имеет нарастание титра специфических антител не менее чем в 4 раза. Оценку результатов производят с учетом анамнестических данных: вакцинация, пассивная иммунизация (введение противоэнцефалитной сыворотки или иммуноглобулина).
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические исследования. Иммунохимические исследования. С целью экспресс-диагностики клещевого энцефалита применяют методы определения зараженности клеща, извлеченного из места укуса. Основным методом является ИФ. Готовят мазки-отпечатки и обрабатывают флюоресцирующими антителами к антигенам вируса клещевого энцефалита. В положительном случае наблюдается специфическое свечение скоплений вирусных антигенов внутри клеток, присутствующих в материале. Наличие антигенов вируса в организме клеща можно определить и с помощью других иммунологических методов (РНГА со взвесью исследуемого материала и эритроцитами, нагруженными антителами к вирусу клещевого энцефалита, ИФА и др.). Предварительный ответ получают спустя 2-3 ч.
• Микробиологическая диагностика энцефалитов, вызывае
мых другими арбовирусами и аренавирусами
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Лабораторная диагностика энцефалитов, вызываемых арбовирусами и аренавирусами, осуществляется аналогично диагностике весенне-летнего клещевого энцефалита. Необходимо помнить, что наличие сходных групповых антигенов у арбови-русов во многих случаях не позволяет установить, какой именно возбудитель из группы родственных вирусов явился причиной заболевания.
• Микробиологическая диагностика бешенства
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: слюна животного, явившегося источником заражения; соскобы с роговицы глаза, биоптаты кожи (затылочной области), кровь, спинномозговая жидкость (при необходимости подтверждения клинического диагноза); биоптаты мозга (для постмортальной диагностики).
МЕТОДЫ ДИАГНОСТИКИ:
Гистологическое исследование. При постмортальной диагностике бешенства проводят морфологическое исследование срезов головного мозга (области гиппокампа и мозжечка), окрашенных метиленовым синим и эозином. В 70—90 % случаев в зараженных нейронах удается обнаружить признаки характерного
ЦПД вируса бешенства — присутствие внутрицитоплазматичес-ких включений — телец Бабеша—Негри (рис. 19.1.1; на вклейке). Тельца окрашиваются в фиолетово-красный цвет, имеют округлую или овальную, реже неправильную форму, диаметр 4—10 мкм.
Вирусологическое исследование и биопроба. Слюну подозрительного животного вводят интрацеребрально новорожденным белым мышам. Реже для выделения вируса из слюны применяют клеточные культуры (линии VERO, диплоидные клетки человека и др.). Присутствие вируса в биоптатах мозга зараженных мышат или клетках культуры определяют по наличию его антигенов с помощью метода ИФ. Для этого срезы мозга или клетки зараженной культуры обрабатывают флюоресцирующими противовирусными антителами. В положительном случае при люминесцентной микроскопии препаратов наблюдается специфическое свечение в цитоплазме зараженных клеток.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Присутствие антигенов вируса в соскобах с роговицы глаза, биоптатах кожи или биоптатах мозга (при постмортальной диагностике) выявляют методом ИФ (см. выше). Необходимо помнить, что тесты становятся положительными только на поздних стадиях заболевания и применяются исключительно с целью подтверждения клинического диагноза.
Молекулярно-биологические исследования. Вирусные НК в исследуемом материале обнаруживают с помощью ПЦР или метода зондов.
Серодиагностика. Наличие противовирусных антител в крови и спинномозговой жидкости пациента определяют методом непрямой ИФ и в РН (в культуре клеток или на белых мышах). Серодиагностика, как и другие существующие методы лабораторной диагностики бешенства, не позволяет своевременно установить диагноз, поскольку антитела в организме больного появляются только на поздних стадиях заболевания.
• Микробиологическая диагностика поражений ЦНС при вирусном паротите
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: спинномозговая жидкость (собирают в стерильный контейнер и сохраняют при +4 °С не более 48 ч). При необходимости более длительного хранения материал замораживают и хранят при —70 "С.
МЕТОДЫ ДИАГНОСТИКИ:
Вирусологическое исследование. Выделение чистой культуры вируса из спинномозговой жидкости является ведущим методом диагностики поражений ЦНС при вирусном паротите (см. главу 21).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Методы обнаружения антигенов возбудителя в исследуемом материале — см. главу 21.
Молекулярно-биологические исследования. Вирусные НК в исследуемом материале обнаруживают с помощью ПЦР или метода ДНК-зондов.
• Микробиологическая диагностика поражений ЦНС, вызванных вирусом кори
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: спинномозговая жидкость, биоптат тканей ЦНС.
МЕТОДЫ ДИАГНОСТИКИ:
Цитологическое исследование. Спинномозговую жидкость центрифугируют, из осадка, содержащего слущенные клетки, готовят мазки. Мазки или препараты тканей головного мозга окрашивают по методу Романовского—Гимзы. В положительном случае удается обнаружить признаки ЦПД — гигантские многоядерные клетки, часто содержащие внутрицитоплазмати-ческие включения. В поздних стадиях заболевания, а также при хронических формах инфекции (в частности, подостром скле-розирующем панэнцефалите — ПСПЭ) типично появление внутриядерных включений. Метод обладает низкой чувствительностью и специфичностью.
Вирусологическое исследование. Вирус кори с трудом удается культивировать in vitro, поэтому выделение чистой культуры возбудителя из исследуемого материала редко применяют с диагностической целью (см. главу 21). Другой причиной является низкое содержание вируса в спинномозговой жидкости. Необходимо помнить, что при ПСПЭ в организме персисти-рует дефектный вирус, который не удается культивировать с помощью стандартных методов. В этом случае применяют метод совместного культивирования клеток ткани мозга или периферической крови пациента с культурой клеток, чувствительных к вирусу. Исследование занимает не менее 1 мес. Присутствие вируса определяют по ЦПД и путем выявления его антигенов методом ИФ.
Экспресс-методы диагностики: иммунохимические и молекулярно-биологические исследования. Иммунохимические исследования. Присутствие антигенов вируса в клетках био-птата мозга и слущенных клетках спинномозговой жидкости выявляют методом ИФ (см. главу 21). Необходимо иметь в виду, что отрицательный результат исследования не исключает заболевания, что объясняется малым содержанием вируса в клетках спинномозговой жидкости и сравнительно низкой чувствительностью метода. Присутствие вирусных белков (анти-
генов) в исследуемом материале может быть выявлено с помощью чувствительных серологических реакций: ИФА, РИА и др.
Молекулярно-биологические исследования. Вирусные НК в исследуемом материале обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Обнаружение специфических противовирусных антител в спинномозговой жидкости является ведущим методом диагностики поражений ЦНС, вызываемых вирусом кори. Повышенное содержание противокоревых антител в спинномозговой жидкости является характерным для всех форм патологии ЦНС, обусловленных этим вирусом. Наличие противокоревых антител в спинномозговой жидкости определяют с помощью различных серологических реакций (см. главу 21). Методы ИФА и непрямой ИФ являются наиболее чувствительными и дают положительный результат в большинстве случаев.
• Микробиологическая диагностика поражений ЦНС, вызван
ных вирусом краснухи
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: спинномозговая жидкость.
МЕТОДЫ ДИАГНОСТИКИ:
Серодиагностика. Обнаружение специфических противовирусных антител в спинномозговой жидкости является ведущим методом диагностики поражений ЦНС, вызываемых вирусом краснухи (см. главу 21).
• Микробиологическая диагностика инфекций, вызванных
HTLV-1
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Серодиагностика. Обнаружение противовирусных антител в крови пациента с помощью ИФА применяют в качестве основного метода лабораторной диагностики тропического спастического паралича. В случае положительного результата с целью верификации осуществляют поиск антител к индивидуальным вирусным белкам методом иммуноблоттинга.
• Микробиологическая диагностика инфекций ЦНС, вызван
ных герпесвирусами (вирусы простого герпеса 1 и 2-го типа
(HSV-l, HSV-2), вирус ветряной оспы/опоясывающего
лишая (VZV), цитомегаловирус человека (CMV), вирус
Эпштейна—Барр (ЕВУ).
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: спинномозговая жидкость.
 МЕТОДЫ ДИАГНОСТИКИ: см. главу 21.
МЕТОДЫ ДИАГНОСТИКИ: см. главу 21.
Необходимо помнить, что при герпетическом энцефалите выделение вируса из спинномозговой жидкости не всегда бывает успешным. В этом случае диагноз ставят на основании обнаружения вирусных антигенов, нуклеиновых кислот и ферментов, а также высоких титров противовирусных антител в спинномозговой жидкости.
• Микробиологическая диагностика инфекций ЦНС,
вызванных JCV
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: биоптат из пораженного участка головного мозга.
МЕТОДЫ ДИАГНОСТИКИ:
Цитологическое исследование. Основано на обнаружении измененных клеток с признаками ЦПД (увеличение клеток, наличие одиночных базофильных внутриядерных включений) в биоптатах головного мозга.
Вирусоскопическое исследование. Метод электронной микроскопии позволяет обнаружить зрелые вирусные частицы в клетках пораженных участков головного мозга.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические исследования. Иммунохимические исследования. Обнаружение вирусных антигенов в клетках пораженных участков головного мозга осуществляют методом ИФ.
Молекулярно-биологические исследования. Обнаружение вирусных ДНК в зараженных клетках осуществляют методом ДНК-зондов (ДНК-гибридизация in situ), ПНР.
Серодиагностика — обнаружение антител к вирусным белкам — не информативна, поскольку антитела присутствуют также у здоровых вирусоносителей.
• Микробиологическая диагностика инфекций ЦНС,
вызванных прионами
Общепринятые методы лабораторной диагностики отсутствуют. Диагноз устанавливают преимущественно на основании клинической картины заболевания и подтверждают гистологическим исследованием тканей пораженных участков головного мозга. Наблюдается дегенерация нейронов и аксонов серого вещества головного мозга, накопление амилоидоподобного вещества, образующего бляшки и фибриллярные скопления внутри и вне нейронов, гипертрофия глиальных клеток и другие изменения, характерные для спонгилоформной энцефалопатии. В последние годы разработаны методы иммунохимичес-кого обнаружения аномальной формы приона (РгР^с) в клетках головного мозга методом ИФ. Метод также позволяет продемонстрировать накопление PrPSc в клетках роговицы глаза на ранних стадиях болезни.
• Диагностические, профилактические и лечебные препараты
Диагностические поливалентная и типоспецифические полио-миелитные сыворотки. Применяют для идентификации и типи-рования вирусов полиомиелита.
Диагностические поливалентные и типоспецифические (моновалентные) сыворотки к вирусам Коксаки и ECHO. Применяют для идентификации и типирования соответствующих вирусов.
Пероральная живая вакцина против полиомиелита (трехвалентная). Содержит ослабленные штаммы вирусов полиомиелита I—III типов. Вакцина выпускается в жидком виде и в форме драже. Применяют для профилактики полиомиелита (создание активного иммунитета).
Парентеральная инактивированная вакцина против полиомиелита (трехвалентная). Содержит инактивированные вирусы полиомиелита I— III типов. Применяют для профилактики полиомиелита (создание активного иммунитета).
Диагностикум из вируса клещевого энцефалита. Используют для серодиагностики клещевого энцефалита.
Инактивированная культуральная вакцина против клещевого энцефалита. Стерильный специфический антиген вируса клещевого энцефалита, инактивированного формалином. Применяют для профилактики клещевого энцефалита по эпидемическим показаниям (создание активного иммунитета).
Иммуноглобулин против клещевого энцефалита. Содержит противовирусные специфические антитела, получаемые из сыворотки крови лошадей, гипериммунизированных вирусом клещевого энцефалита. Применяют для лечения и экстренной профилактики клещевого энцефалита (пассивный иммунитет).
Живая антирабическая вакцина Ферми. Изготавливают из мозга молодых овец, зараженных фиксированным (аттенуиро-ванный штамм) вирусом бешенства. Вирус в суспензии мозга обрабатывают 1 % раствором фенола и лиофилизируют. Применяется для создания активного иммунитета с целью профилактики бешенства. Вакцину вводят лицам, укушенным подозрительными на бешенство животными. Поствакцинальный иммунитет развивается через 2 нед и сохраняется в течение 6 мес.
Культуральная убитая антирабическая вакцина. Получают путем химической инактивации вируса бешенства, выращенного в культуре клеток. Применяют для профилактики бешенства (создание активного иммунитета).
Антирабический иммуноглобулин. Получают путем гипериммунизации лошадей фиксированным вирусом бешенства. Применяют для создания пассивного иммунитета с целью профилактики бешенства. Препарат вводят не позднее 72 ч после укуса животного в сочетании с антирабической вакциной. Препарат обезвреживает вирус бешенства и предупреждает развитие поствакцинальных энцефалитов.


 жительный инкубационный период, а также способность к персистенции, что является причиной развития хронической инфекции. Обязательной мерой профилактики заражения вирусным гепатитом при переливании крови является контроль доноров крови на носительство вирусов гепатита. Заболевания, протекающие с поражением печени — гепатитом — в качестве одного из проявлений генерализованной инфекции, способны вызывать также другие вирусы. Наиболее часто гепатит возникает при инфекциях, вызванных вирусом желтой лихорадки, герпесвирусами (CMV, HSV-l, HSV-2, EBV). Гепатит также может развиваться при тяжелых формах кори, паротита, краснухи, вирусных системных лихорадок. Лабораторная диагностика этих инфекций описана в соответствующих главах.
жительный инкубационный период, а также способность к персистенции, что является причиной развития хронической инфекции. Обязательной мерой профилактики заражения вирусным гепатитом при переливании крови является контроль доноров крови на носительство вирусов гепатита. Заболевания, протекающие с поражением печени — гепатитом — в качестве одного из проявлений генерализованной инфекции, способны вызывать также другие вирусы. Наиболее часто гепатит возникает при инфекциях, вызванных вирусом желтой лихорадки, герпесвирусами (CMV, HSV-l, HSV-2, EBV). Гепатит также может развиваться при тяжелых формах кори, паротита, краснухи, вирусных системных лихорадок. Лабораторная диагностика этих инфекций описана в соответствующих главах.
Тема 20.1. МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА КИШЕЧНЫХ ВИРУСНЫХ ИНФЕКЦИЙ И ВИРУСНЫХ ГЕПАТИТОВ
▲ План
▲ Программа
1. Биологические свойства возбудителей кишечных вирусных инфекций и вирусных гепатитов, их патоген-ность, экология, особенности инфекции и эпидемиология вызываемых заболеваний.
2. Микробиологическая диагностика.
3. Диагностические, профилактические и лечебные препараты.
А Демонстрация
1. Реакция преципитации в агаре (встречная диффузия в геле по Оухтерлони) для обнаружения HBs-антигена в сыворотке крови больного вирусным гепатитом В.
2. Диагностические, профилактические и лечебные препараты.
▲ Задание студентам
1. Указать материал для исследования.
2. Учесть результаты выявления специфических HBs-ан-тигенов в сыворотке крови больного с помощью РИГА.
3. Учесть результаты выявления специфических HBs-ан-тигенов в сыворотке крови донора с помощью имму-ноферментного метода.
4. Учесть результаты выявления анти-НВз-антител в сыворотке крови больного с помощью РИГА. Оценить нарастание титра анти-ИВв-антител в динамике заболевания.
5. Учесть результаты выявления в сыворотке больного IgM против вируса гепатита А.
6. Дать краткую характеристику демонстрируемым диагностическим, профилактическим и лечебным препаратам.
• Микробиологическая диагностика кишечных вирусных инфекций
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения.
МЕТОДЫ ДИАГНОСТИКИ:
Вирусоскопическое исследование. Является одним из ведущих методов диагностики кишечных вирусных инфекций. Зрелые вирионы в испражнениях можно обнаружить с помощью метода электронной микроскопии.
Вирусологическое исследование. Применяют исключительно с целью диагностики эпидемий и вспышек кишечных вирусных инфекций. Для выделения реовирусов и ротавирусов из испражнений используют различные типы клеточных культур (HeLa, первичные культуры клеток почек обезьян и др.). Индикацию осуществляют по ЦПД, которое развивается в течение 3 нед и характеризуется появлением внутрицитоплазматичес-ких включений и неспецифической дегенерацией клеток. Ведущим методом идентификации и типирования является анализ фрагментов вирусной РНК методом электрофореза. Выделение чистой культуры вирусов ECHO — см. главу 9. Кишечные коронавирусы, калицивирусы, астровирусы и аденовирусы не удается культивировать in vitro.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические исследования. Иммунохимические исследования. Присутствие антигенов вирусов в испражнениях можно определить с помощью метода ИЭМ (антигены цельных вирионов) и чувствительных серологических реакций (латекс-агглютинации, ИФА, РИФ и др.).
Молекулярно-биологические исследования. Вирусные НК в испражнениях можно обнаружить с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Серодиагностика при кишечных вирусных инфекциях малоинформативна и применяется преимущественно с целью ретроспективной диагностики и для оценки эпидемиологической ситуации. Для определения противовирусных антител в крови пациента применяют различные серологические реакции (РИГА, ИФА, РИА и др.). Ретроспективную диагностику осуществляют методом парных сывороток. Диагностическое значение имеет нарастание титра антител в поздней сыворотке не менее чем в 4 раза. Выявление (методом ИФА) специфических противовирусных иммуноглобулинов класса М (IgM) свидетельствует об активной инфекции.


 • Микробиологическая диагностика вирусного гепатита А
• Микробиологическая диагностика вирусного гепатита А
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, испражнения. МЕТОДЫ ДИАГНОСТИКИ:
Вирусоскопическое исследование. Зрелые вирионы в испражнениях можно обнаружить с помощью метода электронной микроскопии.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические исследования. Иммунохимические исследования. Присутствие антигенов вируса в испражнениях можно определить с помощью метода ИЭМ (антигены цельных вирионов) и чувствительных серологических реакций ИФА, РИА и др. В типичных случаях вирус гепатита А удается обнаружить в фекалиях за 10—14 дней до появления клинических признаков заболевания. Вирус продолжает выделяться с испражнениями в течение 2—3 нед после начала желтухи.
Молекулярно-биологические исследования. Вирусные нуклеиновые кислоты в крови пациента на ранних сроках болезни обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Является ведущим методом диагностики вирусного гепатита А. Для определения противовирусных антител в крови пациента применяют различные серологические реакции (РИГА, ИФА, РИА и др.). Серодиагностику осуществляют методом парных сывороток (диагностическое значение имеет нарастание титра антител в поздней сыворотке не менее чем в 4 раза) или на основании выявления (методом ИФА) специфических противовирусных иммуноглобулинов класса М (IgM), свидетельствующих об активной инфекции. Последние присутствуют в сыворотке крови с первых дней заболевания и исчезают не ранее чем через 3—4 мес.
Для выявления IgM против вируса гепатита А используют различные варианты ИФА. Противовирусные IgM можно выявить следующим способом: на первом этапе на стенках лунок пластиковых планшетов адсорбируют антитела против человеческих IgM, на втором этапе в лунки вносят испытуемую сыворотку в различных разведениях. Фиксированные анти-IgM-антитела связывают все IgM сыворотки, в том числе и противовирусные антитела. Далее вносят стандартный антиген вируса гепатита А и меченые антитела против этого антигена. После инкубации и тщательного промывания буферным раствором с детергентами в лунки добавляют субстрат и хромоген. В положительном случае через несколько минут наблюдается появление окраски.
• Микробиологическая диагностика вирусного гепатита В
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, биоптат печени.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические и молекулярно-биологические исследования. Иммунохимические исследования. Присутствие вирусспецифических антигенов в крови можно определить с помощью различных серологических реакций: иммунопреципитации в геле, РНГА, ИФА, РИА и др. На разных стадиях заболевания и при разных формах инфекции (острой, хронической, вирусоносительстве) в крови присутствуют разные антигены вируса (HBs, НВё), что используют с целью диагностики (табл. 20.1.1). Через 3—5 нед после заражения вирусом гепатита В и за 4—5 нед до появления клинической картины в сыворотке крови больных обнаруживают поверхностный антиген вируса — Я&-антиген (австралийский антиген). Выявление ЯДу-антигена свидетельствует о текущей острой или хронической инфекции и является основным методом контроля крови доноров. Присутствие ЯЯе-антигена является ведущим маркером активной репродукции вируса.
Таблица 20.1.1. Определение антигенов (Аг) и антител (Ат) в крови при лабораторной диагностике вирусного гепатита В
| Период болезни | HBs | НВс | HBe | ||
| Аг | Ат | Ат | Аг | At | |
| Инкубационный период | + | — | — | + | — |
| Продромальный период | + | — | ± (IgM) | + | — |
| Острый период | + | — | + (IgM) | + | — |
| Реконвалесценция: ранняя | — | — | + | — | ± |
| поздняя | — | + | + (IgG) | — | + |
| Хроническая активная форма | + | ± | + (IgG) | + | ± |
| Хроническая бессимптомная | + | — | _ | — | ± |
| форма (носительство) |
Наиболее простой и специфичный, но низкочувствительный метод обнаружения Я&-антигена — реакция встречной иммунодиффузии в геле. Сыворотку крови больного вносят в периферические лунки агаровой пластинки, в центральную лунку вносят стандартную сыворотку акт-HBs, полученную от переболевших гепатитом В. Учет реакции производят через 48—72 ч по появлению дуг преципитации между лунками.
Наиболее простым из чувствительных методов выявления ЯЯу-антигена является РНГА. В этой реакции используют эритроцитарный антительный диагностикум, т.е. эритроциты, нагруженные гипериммунным анти-ЯА-иммуноглобулином. Чувствительность РНГА в 100 раз выше, чем реакции преципитации в геле. К наиболее чувствительным реакциям относится ИФА, основанный на принципе "сандвича". Первона-
 чально на поверхности твердой фазы (полимера) адсорбируют анти-
чально на поверхности твердой фазы (полимера) адсорбируют анти- 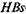 -антитела из стандартной сыворотки. Обычно используют лунки микротитрационных панелей. На втором этапе в отмытые лунки вносят исследуемую сыворотку крови больного. При наличии
-антитела из стандартной сыворотки. Обычно используют лунки микротитрационных панелей. На втором этапе в отмытые лунки вносят исследуемую сыворотку крови больного. При наличии 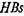 -антигена он связывается фиксированными на твердой фазе антителами. На третьем этапе добавляют анти-
-антигена он связывается фиксированными на твердой фазе антителами. На третьем этапе добавляют анти- 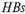 -антитела, несущие ферментную метку. В качестве метки используют фермент пероксидазу. Для выявления связанных антигеном меченых антител в отмытые лунки добавляют субстрат — пероксид водорода и хролюген — ортофенилендиамин, который окисляется в присутствии кислорода, выделяющегося при разложении пероксида водорода под воздействием фермента с образованием продуктов желто-коричневого цвета. Степень окраски отражает интенсивность связывания меченых антител, которая пропорциональна количеству
-антитела, несущие ферментную метку. В качестве метки используют фермент пероксидазу. Для выявления связанных антигеном меченых антител в отмытые лунки добавляют субстрат — пероксид водорода и хролюген — ортофенилендиамин, который окисляется в присутствии кислорода, выделяющегося при разложении пероксида водорода под воздействием фермента с образованием продуктов желто-коричневого цвета. Степень окраски отражает интенсивность связывания меченых антител, которая пропорциональна количеству 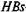 -антигена в исследуемой сыворотке.
-антигена в исследуемой сыворотке.
Реакции РНГА, ИФА, РИА и другие могут быть использованы и для выявления 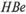 -антигена в исследуемой сыворотке.
-антигена в исследуемой сыворотке.
В биоптатах печени при активной форме инфекции можно выявить наличие НВс-антигена, ассоциированного с гепатоци-тами, методом ИФ.
Молекулярно-биологические исследования. Вирусные ДНК в крови пациента обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. На разных стадиях заболевания и при разных формах инфекции (острой, хронической, вирусоноситель-стве) в крови присутствуют антитела к разным антигенам вируса гепатита В (HBs, HBc, НВе), что используют с целью диагностики (см. табл. 20.1.1). Для определения антител применяют различные серологические реакции: РНГА, ИФА, РИА и др. (см. выше).
Так, для выявления анти- 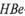 -антител в исследуемой сыворотке необходим соответствующий эритроцитный диагности-кум — эритроциты, нагруженные стандартным
-антител в исследуемой сыворотке необходим соответствующий эритроцитный диагности-кум — эритроциты, нагруженные стандартным 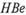 -антигеном. Реакцию, как правило, ставят с парными сыворотками. В тесте ИФА на поверхности твердой фазы адсорбируют стандартный
-антигеном. Реакцию, как правило, ставят с парными сыворотками. В тесте ИФА на поверхности твердой фазы адсорбируют стандартный 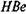 -антиген, на втором этапе вносят исследуемую сыворотку в десятикратных разведениях, инкубируют, отмывают и добавляют меченую антиглобулиновую сыворотку.
-антиген, на втором этапе вносят исследуемую сыворотку в десятикратных разведениях, инкубируют, отмывают и добавляют меченую антиглобулиновую сыворотку.
Выявление антител к 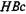 -антигену свидетельствует об активной инфекции и является одним из методов контроля крови доноров. Определение анти-
-антигену свидетельствует об активной инфекции и является одним из методов контроля крови доноров. Определение анти- 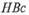 IgM является ведущим методом дифференциальной диагностики острого и хронического активного вирусного гепатита В.
IgM является ведущим методом дифференциальной диагностики острого и хронического активного вирусного гепатита В.
• Микробиологическая диагностика вирусного гепатита С МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики. Молекулярно-биологические исследования. Вирусную РНК в крови пациента обнаруживают с помощью ПЦР или методом ДНК-зондов.
Серодиагностика. Является ведущим методом диагностики хронического вирусного гепатита С и контроля крови доноров. Противовирусные антитела в крови пациентов определяют с помощью чувствительных серологических реакций (ИФА, РИА и др.) с рекомбинантным вирусным антигеном. Необходимо иметь в виду, что в остром периоде заболевания антитела в крови присутствуют в низком титре и часто в комплексе с антигеном, поэтому их выявление не всегда удается.
• Микробиологическая диагностика вирусного гепатита D
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические и молекулярно-биологические исследования. Иммунохимические исследования. Присутствие дельта-антигена в крови можно определить с помощью чувствительных серологических реакций ИФА, РИА и др.
Молекулярно-биологические исследования. Вирусную НК в исследуемом материале обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Является ведущим методом диагностики вирусного гепатита D и контроля крови доноров. Антитела к дельта-антигену в крови пациентов определяют с помощью чувствительных серологических реакций (ИФА, РИА и др.).
• Микробиологическая диагностика вирусного гепатита G
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические и молекулярно-биологические исследования:
Иммунохимические исследования. Присутствие антигенов вируса гепатита G в крови можно определить с помощью чувствительных серологических реакций ИФА, РИА и др.
Молекулярно-биологические исследования. Вирусную НК в исследуемом материале обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Является ведущим методом диагностики вирусного гепатита G и контроля крови доноров. Антитела к антигенам вируса гепатита G в крови пациентов определяют с помощью чувствительных серологических реакций (ИФА, РИА и др.).

| Глава 21 |
• Микробиологическая диагностика вирусного гепатита Е
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, испражнения, желчь.
МЕТОДЫ ДИАГНОСТИКИ:
Вирусоскопическое исследование. Зрелые вирионы в испражнениях и желчи можно обнаружить с помощью метода электронной микроскопии.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические исследования. Иммунохимические исследования. Присутствие антигенов вируса в испражнениях можно определить с помощью метода ИЭМ (антигены цельных вирионов).
Молекулярно-биологические исследования. Вирусную НК в исследуемом материале обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Является ведущим методом диагностики вирусного гепатита Е. Противовирусные антитела в крови пациентов определяют с помощью чувствительных серологических реакций (ИФА, РИА и др.). Серодиагностику осуществляют методом парных сывороток (диагностическое значение имеет нарастание титра антител в поздней сыворотке не менее чем в 4 раза) или на основании выявления (методом ИФА) специфических противовирусных иммуноглобулинов класса М (IgM), свидетельствующих об активной инфекции.
• Микробиологическая диагностика желтой лихорадки
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики. Молекулярно-биологические исследования. Вирусные нуклеиновые кислоты в исследуемом материале можно обнаружить с помощью ПЦР.
Серодиагностика. Является ведущим методом диагностики желтой лихорадки. Противовирусные антитела в крови пациентов определяют с помощью чувствительных серологических реакций (РСК, РТГА, ИФА, РИА и др.). Серодиагностику осуществляют методом парных сывороток (диагностическое значение имеет нарастание титра антител в поздней сыворотке не менее чем в 4 раза) или на основании выявления (методом ИФА) специфических противовирусных иммуноглобулинов класса М (IgM), свидетельствующих об активной инфекции.
• Диагностические, профилактические и лечебные
препараты
Стандартный Яй$-антиген. Применяют для серодиагностики вирусного гепатита В.
Иммуноглобулин нормальный человеческий. Получают из крови человека (донорской, плацентарной) путем фракционирования. Применяют для профилактики вирусного гепатита А при контакте (создание пассивного иммунитета).
Вакцина субъединичная против гепатита В. Получена генно-инженерным путем, содержит #&-антиген вируса гепатита В. Применяют для создания активного иммунитета с целью профилактики вирусного гепатита В. Вводят парентерально контингентам риска.
Иммуноглобулин человеческий amu-HBV. Получают путем фракционирования из крови доноров с высоким титром антител к вирусу гепатита В. Применяют для профилактики вирусного гепатита В при контакте (создание пассивного иммунитета).
Вакцина живая ослабленная против желтой лихорадки. Содержит авирулентный штамм вируса желтой лихорадки. Применяют для профилактики желтой лихорадки (создание активного иммунитета). Вводят контингентам риска.
Противовирусные препараты: интерферон человеческий лейкоцитарный; интерферон рекомбинантный. Применяют для лечения вирусного гепатита С.
 2015-05-30
2015-05-30 3887
3887








