Термодинамическая оценка совместного разряда ионов Me1n+ и Me2m+ делается на основании равенства равновесных потенциалов разделяемых металлов Me1 и Ме2 с учетом их состояния в солевом и жидкометаллическом растворителе (Me):
E1 = Е2 = Е;
Е = E°1 + 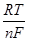 ln
ln 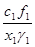 ;
;
Е = Еo2 + 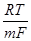 ln
ln 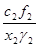 , (3.25)
, (3.25)
где E°1, E°2 - стандартные потенциалы Me1, Ме2;
c1, c2 и f1,f2 - ионные доли и коэффициенты активности ионов Me1n+, Me2m+ в электролите;
x1, x2 и g1, g2 - атомные доли и коэффициенты активности атомов Me1, Me2 в жидком Me;
Е - потенциал сплава.
Учитывая, что коэффициент разделения Q определяется как частное от деления коэффициентов распределения разделяемых металлов между электролитом и металлической фазой
Q= 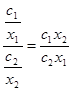 , (3.26) (4.26)
, (3.26) (4.26)
после преобразований равенства (3.25) получаем
lnQ= 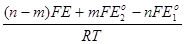 + In
+ In 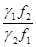 . (3.27)
. (3.27)
Для разбавленных растворов электролитов, подчиняющихся закону Генри (f1 и f2 постоянны), удобнее пользоваться величинами условных стандартных потенциалов (E*1, E*2):
Е*1=E°1+ 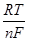 lnf1; (3.28)
lnf1; (3.28)
E*2=E°2+ 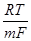 lnf2. (3.29)
lnf2. (3.29)
Выражение (3.27) при этом упрощается:
lnQ= 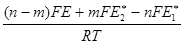 + ln
+ ln 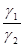 . (3.30)
. (3.30)
При n=m коэффициент разделения не зависит от потенциала сплава Е, уравнение (3.30) принимает вид
lnQ= 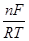 (E*2-Е*1) + ln
(E*2-Е*1) + ln 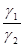 . (3.31)
. (3.31)
Ниже приведены результаты расчета по уравнению (3.31) коэффициентов разделения урана и лантана в расплаве на основе KCl-LiCI при 1000 К на различных легкоплавких металлах.
Me Tl Cd Pb In Bi Sn Zn Ga Al
Q 0,9 15 41 63 92 232 530 7800 5×105
Видно, что величина коэффициента разделения в очень сильной степени зависит от природы металлического растворителя, изменяясь в рассматриваемом случае от таллия к алюминию более чем на пять порядков. Таллиевые электроды являются наиболее подходящими для совместного выделения урана и лантана (Q®1), алюминиевые - для эффективного разделения этих элементов(Q= 5×105).
В условиях рафинирования металла Ме2 и малых содержаний в нем электроотрицательного металла Me1g2 = 1, а уравнение (3.3) принимает вид:
lnQ = 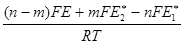 + lng1, (3.32)
+ lng1, (3.32)
где g1- коэффициент активности Me1 в Me2.
В условиях концентрационной поляризации прилегающие слои электрода и электролита находятся в равновесии. Можно записать
lnQi = 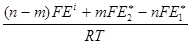 + ln
+ ln 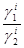 , (3.33)
, (3.33)
где Еi - потенциал электрода под током,
gi1,gi2- коэффициенты активности Me1 и Me2 в поверхностном слое катода.
Довольно часто g1=gi1, g2=gi2. Если соблюдается это условие, то, разделив уравнение (3.33) на (3.30) и произведя необходимые упрощения, получаем достаточно строгое соотношение
ln 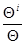 =
= 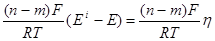 , (3.34) связывающее коэффициенты разделения, достигаемые при электролизе QI, с величинами равновесного коэффициента разделения Q, рассчитываемого по термодинамическим данным, и концентрационной поляризации h, независимо от того, с какой фазой (водной или металлической) она связана.
, (3.34) связывающее коэффициенты разделения, достигаемые при электролизе QI, с величинами равновесного коэффициента разделения Q, рассчитываемого по термодинамическим данным, и концентрационной поляризации h, независимо от того, с какой фазой (водной или металлической) она связана.
В работах Л.Е.Ивановского и О.С.Петенева предлагается более громоздкое и менее строгое выражение
Qi= 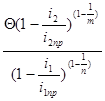 , (3.35) которое не учитывает концентрационную поляризацию катода со стороны сплава. Для того чтобы воспользоваться уравнением (3.35), необходимо знать величину равновесного коэффициента разделения (Q), валентности разделяемых ионов (n,m), предельные (i1пр, i2пр) и фактические (i1,i2) плотности тока для обоих компонентов.
, (3.35) которое не учитывает концентрационную поляризацию катода со стороны сплава. Для того чтобы воспользоваться уравнением (3.35), необходимо знать величину равновесного коэффициента разделения (Q), валентности разделяемых ионов (n,m), предельные (i1пр, i2пр) и фактические (i1,i2) плотности тока для обоих компонентов.
В соответствии с (3.34) при n=m величина Qi не зависит от поляризации и равна равновесному значению коэффициента разделения. Из соотношения (3.35) такой вывод не следует, хотя, на практике он подтверждается.
Уравнения (3.27) и (3.33) позволяют в принципе учесть влияние на коэффициенты разделения также и величины фазовой поляризации через нахождение значений коэффициентов активности разделяемых металлов в поверхностном слое катода под током (gi1,gi2) и в условиях достижения равновесия в системе (g1,g2).
По величинам потенциалов Е и Еi находятся активности a1, a2 и ai1, ai2 и устанавливается состав х1, х2 и хi1, хi2 поверхностных фаз, что позволяет найти нужные величины коэффициентов активности по уравнению
gi=ai/хi. (3.36)
При электрохимической поляризации условием совместного разряда ионов является равенство электродных потенциалов осаждаемых металлов под током:
E Ме1n+/Ме1 + h1 = E Ме2m+/Ме2 + h2. (3.37)
Если известны равновесные потенциалы, природа и характеристики поляризации, легко можно провести теоретический анализ.
Для совместного разряда катионов металла и водорода в условиях электрохимической поляризации такой анализ выполнен О.А.Есиным:
iMе = Крме Сме n+ ×exp [-aме n+× 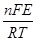 ], (3.38)
], (3.38)
iH = КрH СH+ ×exp [-aH+× 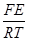 ], (3.39)
], (3.39)
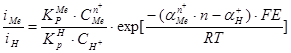 . (3.40)
. (3.40)
Это соотношение известно как формула О.С.Есина. Если aмеn+× n = aH+, то формула (3.40) упрощается:
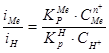 . (3.41)
. (3.41)
В этом случае соосаждение металла и водорода на катоде происходит со скоростями iн, iMe, зависящими лишь от соотношения концентраций их ионов в электролите, и не зависит от потенциала (поляризации) катода.
Этот случай имеет место, например, при осаждении кадмия из перхлоратных электролитов (aH+ = 0,48, 2aСd2+ =0,46), при осаждении меди из сульфатных электролитов (aH+ = 0,58, 2(aСu2+=0,64) и т.д.
В общем случае необходимо пользоваться уравнением (3.37)- см.разд. 2.2, пример совместного выделения свинца и водорода.
Анализ совместного разряда можно проводить на основе поляризационных кривых (рис.3.8).
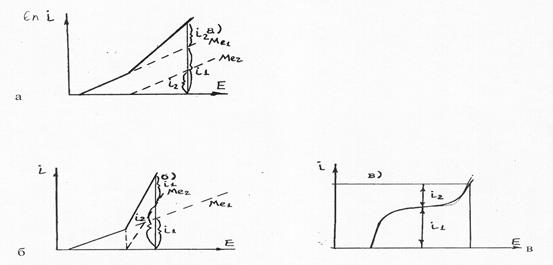
Рис.3.8. Анализ совместного разряда ионов по поляризационным кривым:
а - электрохимическая поляризация при a1=a2;
б - электрохимическая поляризация при a2>a1;
в - диффузионный контроль по Me1n+
 2015-05-22
2015-05-22 1331
1331








