3.6.1. Совместный разряд ионов металла и водорода
В условиях электролиза последовательность и кинетика выделения элементов определяются не только величиной равновесного потенциала, но и величиной поляризации электродов, которая может быть существенно различна для конкурирующих реакций. Их скорости находят из условия равенства под током потенциалов осаждаемого металла и водорода:
EoMen+/Me+ 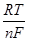 lnCмen++hMe=EoH+/H+
lnCмen++hMe=EoH+/H+ 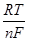 lnCн++hH(Me), (3.63)
lnCн++hH(Me), (3.63)
где hме - поляризация при выделении металла;
hн(Ме) - поляризация при выделении водорода на Ме.
Пример
Рассчитать выход по току цинка при 30°С при электролизе раствора, содержащего 1 моль×л-1ZnSО4, 1 моль×л-1 Н2SО4, если EoZn2+/Zn= -0,763 В, io,Zn=1,1×10-3 А×см-2, a = 0,25, перенапряжение выделения водорода на цинке hH(Zn),B=-(1,24+0,12lgiH).
Решение
По параметрам электрохимической кинетики (io,a) находим зависимость поляризации цинкового катода от плотности тока, идущего на осаждение цинка (iZn):
b = (-2,3× 8,314× 303)/(0,25× 2× 96484) = -0,12, a =-blgiо=О0,355;
hZn,B=-(0,355 + 0,12 lgizn). Подставляем соответствующие величины в уравнение (3.63):
-0,763 + 0 - 0,355 - 0,12 lg izn = 0 + 0 - 1,24 - 0,121giH,
0,12 lg (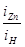 )=0,122, lg (
)=0,122, lg (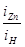 )- 1,015, (
)- 1,015, (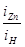 ) =10,3,
) =10,3,
hт= 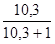 = 0,915.
= 0,915.
Выход по току цинка составит 91,5%.
 2015-05-22
2015-05-22 534
534








