Общая постановка задачи:
1. По справочным данным (Приложение. Таблицы 5.1 – 5.8) построить на миллиметровой бумаге фазовую диаграмму.
2. К какому типу систем относится заданная Вам жидкая смесь?
3. Поясните причину отклонения от аддитивного закона Рауля.
4. Рассчитайте число степеней свободы (вариативность) для каждого поля диаграммы, линий, точек согласно правилу фаз Гиббса.
5. Определите состав пара, находящегося в равновесии с раствором при молярной доле компонента А, равной 0,3.
6. Рассчитайте молярную долю компонента А в первой капле дистиллята, когда раствор перегоняется из простой перегонной колбы, имеющей одну теоретическую тарелку, для растворов, содержащих по 10 г обоих компонентов.
7. Для смесей, образующих азеотропы, укажите интервал концентраций, для которых фракционной перегонкой можно получить чистый компонент В.
Приложения
Равновесные концентрации жидкость – пар при 760 мм рт. ст.
Χ – молярная доля первого компонента смеси в жидкой фазе, Y - молярная доля первого компонента смеси в паровой фазе
Таблица 5.1. Метанол – этанол
| Т,оС | 78,4 | 77,3 | 75,8 | 75,2 | 74,3 | 73,5 | 72,5 | 71,4 | 71,0 | 70,6 | 69,0 | 68,3 | 67,6 |
| Х | 5,6 | 14,2 | 19,0 | 24,0 | 28,7 | 34,5 | 40,0 | 43,4 | 48,0 | 58,7 | 63,0 | 68,3 | |
| Y | 8,9 | 19,4 | 26,1 | 32,7 | 38,6 | 47,0 | 60,1 | 56,0 | 60,0 | 71,6 | 75,1 | 79,1 |
| 67,3 | 66,4 | 65,6 | 64,7 |
| 74,5 | 78,8 | 91,0 | 100,0 |
| 81,8 | 87,0 | 95,0 | 100,0 |
Таблица 5.2. Метанол – бензол
| Т,оС | 80,2 | 71,6 | 67,5 | 64,5 | 63,8 | 63,3 | 58,7 | 59,4 | 61,5 | 61,6 | 64,7 |
| Х | 2,3 | 4,0 | 6,4 | 7,6 | 8,1 | 33,4 | 86,0 | 94,0 | 94,6 | 100,0 | |
| Y | 25,6 | 37,8 | 43,2 | 44,3 | 47,2 | 56,5 | 72,7 | 83,3 | 83,3 | 100,0 |
Таблица 5.3. Этанол – бензол
| Т,оС | 80,2 | 69,7 | 68,3 | 68,1 | 68,4 | 69,0 | 71,5 | 78,5 |
| Х | 15,5 | 30,2 | 50,1 | 60,0 | 70,0 | 84,2 | 100,0 | |
| Y | 33,4 | 40,7 | 46,4 | 50,2 | 54,4 | 67,5 | 100,0 |
Таблица 5.4. Пропанон - бутанон
| Т,оС | 79,6 | 77,8 | 74,4 | 71,9 | 69,5 | 67,4 | 64,8 | 62,8 | 60,6 | 58,4 | 56,4 |
| Х | 5,7 | 17,0 | 26,3 | 35,3 | 43,7 | 55,2 | 65,3 | 76,3 | 88,0 | 100,0 | |
| Y | 8,6 | 24,4 | 37,0 | 47,5 | 56,5 | 67,0 | 76,0 | 84,7 | 93,3 | 100,0 |
Таблица 5.5. Метилэтаноат – этилэтаноат
| Т,оС | 56,4 | 58,0 | 59,8 | 61,5 | 63,3 | 65,2 | 67,2 | 69,6 | 72,0 | 77,2 |
| Х | 10,0 | 20,0 | 30,0 | 40,0 | 50,0 | 60,0 | 70,0 | 80,0 | 100,0 | |
| Y | 16,8 | 31,0 | 42,7 | 53,5 | 63,6 | 73,0 | 81,5 | 88,5 | 100,0 |
Таблица 5.6. Этанол - анилин
| Т,оС | 184,4 | 137,3 | 124,0 | 114,5 | 110,4 | 98,7 | 87,2 | 85,0 | 82,1 | 78,4 |
| Х | 5,8 | 10,0 | 15,0 | 17,4 | 31,2 | 55,5 | 64,5 | 78,4 | 100,0 | |
| Y | 85,3 | 91,4 | 93,2 | 94,1 | 96,0 | 98,4 | 98,8 | 99,2 | 100,0 |
Таблица 5.7. Этанол – пропанон (ацетон)
| Т,оС | 56,21 | 57,31 | 58,43 | 60,53 | 62,18 | 64,82 | 67,81 | 72,20 | 74,73 | 78,30 |
| Х | 12,5 | 25,0 | 37,5 | 50,0 | 62,5 | 75,0 | 87,5 | 93,8 | 100,0 | |
| Y | 8,3 | 16,1 | 23,8 | 31,2 | 41,4 | 52,6 | 70,6 | 80,2 | 100,0 |
Азеотроп: Т = 56,64оС; Х = 3,62
Таблица 5.8. Метанол – метилэтаноат (метиловый эфир уксусной кислоты)
| Т,оС | 56,86 | 54,50 | 53,90 | 53,82 | 53,88 | 55,04 | 55,50 | 57,80 | 64,70 |
| Х | 15,1 | 29,0 | 35,2 | 40,5 | 62,0 | 67,9 | 68,7 | 100,0 | |
| Y | 21,2 | 30,9 | 34,3 | 37,1 | 48,4 | 52,3 | 65,8 | 100,0 |
Азеотроп: Т =53,5 оС; Х = 35,2
Таблица 5.9. Показатели преломления (nD20) и плотности (ρ,г/см3) некоторых жидкостей при температуре 20оС
| № | Вещество | nD20 | ρ,г/см3 | № | Вещество | nD20 | ρ,г/см3 |
| Анилин | 1,5863 | 1,0218 | Гептан | 1,38764 | 0,6836 | ||
| Ацетон | 1,35911 | 0,7905 | Толуол | 1,49693 | 0,8670 | ||
| Бензол | 1,50110 | 0,8790 | Хлороформ | 1,4456 | 1,4890 | ||
| Вода | 1,333 | 0,9982 | СС14 | 1,4603 | 1,5939 | ||
| Глицерин | 1,4744 | 1,2594 | Этиленгликоль | 1,4318 | - | ||
| Метанол | 1,3286 | 0,7915 | Муравьиная к. | 1,3716 | - | ||
| Этанол | 1,3613 | 0,7895 | Уксусная к-та | 1,3717 | 1,0491 |
Литература
1. Практикум по физической химии /Под ред. В.В.Буданова, Н.К.Воробьева - М.: Химия, 1986. – 352 с.
2. Практические работы по физической химии: Учебное пособие для вузов /Под ред. К. П. Мищенко, А. А. Равделя, А. М. Пономаревой – Л.: Химия, 1982. – 400 с.
3. Справочник химика. Т.Ш. 2-е изд. М.-Л.: Химия, 1964. 1005 с.
Тесты к модульному зачету по теме «Фазовые равновесия»
1. Какое определение наиболее полно характеризует понятие «фаза термодинамической системы»?
А) Часть термодинамической системы, ограниченная видимой поверхностью раздела.
Б) Гомогенная часть термодинамической системы.
В) Совокупность гомогенных частей системы, одинаковых во всех точках по составу и свойствам и ограниченных от других частей системы поверхностью раздела.
Г) Одно из веществ, входящих в состав термодинамической системы, взятое в определенном агрегатном состоянии.
2. Какое определение наиболее полно соответствует понятию «компоненты термодинамической системы»?
А) Вещества, которые могут быть выделены из системы и существовать вне нее.
Б) Индивидуальные химические вещества, наименьшее число которых необходимо и достаточно для образования всех фаз равновесной системы.
В) Вещества с неограниченной взаимной растворимостью в жидкой или твердой фазах.
Г) Индивидуальные химические вещества, образующие термодинамическую систему в результате химического взаимодействия друг с другом.
3. Что такое степень свободы или вариативность термодинамической системы?
А) Это число параметров системы, которые можно менять независимо друг от друга, не меняя при этом числа и вида фаз системы.
Б) Это число параметров системы, связанных между собой какой – либо математической зависимостью.
В) Это число независимых параметров системы.
Г) Это минимальное число веществ, необходимое и достаточное для образования всех фаз системы.
4. Какое из определений соответствует понятию: а) диаграмма состояния,
б) фазовая диаграмма?
А) Диаграмма состояния, на которой изображены разные фазы: жидкая, газообразная, все аллотропные модификации вещества в твердом агрегатном состоянии.
Б) Графическое выражение зависимостей между значениями переменных, определяющих состояние системы (объем, давление, температура, концентрация веществ и пр.).
В) Графическое выражение зависимости между составом системы и температурой или давлением.
Г) Диаграмма, на которой показана взаимная растворимость компонентов системы.
5. Как называются смеси жидких веществ с постоянной температурой кипения?
А) Идеальные.
Б) Изоморфные.
В) Азеотропные.
Г) Гомогенные.
Д) Постоянно кипящие.
Е) Гетерогенные.
6. Какие растворы могут быть разделены путем перегонки на чистые компоненты?
А) Имеющие достаточно большую разницу в температурах кипения компонентов.
Б) Растворы, содержащие компоненты, отличающиеся по природе и полярности связей в молекулах.
В) Растворы, обладающие точками экстремума на диаграммах «температура кипения - состав».
Г) Не имеющих экстремумов на диаграммах «температура кипения - состав».
7. Каким условиям отвечает равновесие термодинамической системы?
А) Одинаковое агрегатное состояние всех компонентов системы.
Б) Равенство химических потенциалов каждого компонента во всех фазах.
В) Минимальное значение энергии Гиббса или энергии Гельмгольца.
Г) Минимальное значение энтропии.
Д) Отсутствие видимых процессов или явлений.
8. Для какой термодинамической системы правило фаз Гиббса будет иметь следующий вид:
1) V усл. = С - φ + 1
2) Vусл. = С – φ + 3?
А) Температура или давление – постоянная величина.
Б) Концентрации компонентов одинаковы.
В) Компоненты системы находятся в тонкодисперсном состоянии.
Г) Концентрации компонентов одинаковы во всех фазах.
9. Какими технологическими приемами можно сместить положение азеотропной точки?
А) Изменить давление, при котором ведется перегонка.
Б) Изменить температуру перегонки.
В) Ввести третий жидкий компонент – это изменит отношение давления паров в азеотропной смеси.
Г) Ввести твердый компонент (силикагель, животный уголь), избирательно адсорбирующий один из компонентов.
Д) Изменить состав перегоняемой жидкой смеси.
Е) Ввести вещество, химически реагирующее с одним из компонентов азеотропной смеси.
10. Каковы причины отклонения реальных растворов от идеальности?
А) Наличие дипольных взаимодействий между компонентами раствора.
Б) Образование водородных связей между компонентами раствора.
В) Подчинение закону Рауля.
Г) Явления ассоциации и диссоциации компонентов.
Д) Подчинение объема смеси закону аддитивности.
11. Почему при кипении реальных растворов состав равновесного пара находится экспериментально, а не рассчитывается по уравнению: 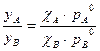 ?
?
А) Давление паров над реальным раствором может иметь существенные отклонения от рассчитанного по закону Рауля.
Б) Состав равновесного пара непрерывно меняется по мере отгонки легколетучего компонента.
В) Так как неизвестны давления насыщенных паров компонентов при конкретно заданной температуре.
Г) Приведенное уравнение пригодно только для идеальных растворов.
12. На рис. 1 – 4 приведены фазовые диаграммы кипения двухкомпонентных жидких систем. Установите соответствие рисунка определенному типу системы.
Т Р = const





А В
1 2 3 4
А) Система с ограниченной взаимной растворимостью компонентов.
Б) Идеальный раствор.
В) Смесь двух взаимно нерастворимых жидкостей.
Г) Реальный раствор со значительным отклонением от закона Рауля.
13. На рис. 1 – 4 приведены фазовые диаграммы кипения бинарных растворов. Установите соответствие рисунка типу системы.
Т Р = const





А В
1 2 3 4
А) Идеальный раствор.
Б) Раствор с незначительным положительным отклонением от закона Рауля.
В) Раствор с незначительным отрицательным отклонением от закона Рауля.
Г) Раствор со значительным положительным отклонением от закона Рауля.
14. Какие из перечисленных технологических операций позволяют разделить жидкие бинарные смеси?
А) Ректификация.
Б) Экстракция.
В) Гидратация.
Г) Переэтерификация.
Д) Темперирование.
Е) Дистилляция.
15. С какой целью применяется перегонка (дистилляция) с водяным паром?
А) Для смещения азеотропной точки.
Б) Для очистки летучих веществ от компонентов с низкой летучестью.
В) Для уменьшения температуры отгонки термически нестойких компонентов.
Г) Для увеличения выхода летучего компонента.
16. На фазовых диаграммах кипения бинарных смесей (растворов) нода – это линия…..
А) Постоянства состава жидкой смеси,
Б) Связывающая температуры кипения чистых жидкостей.
В) Или ось состава жидкой смеси.
Г) Связывающая равновесные составы жидкости и пара.
17. Положительные отклонения от закона Рауля присущи большинству гомогенных жидких систем. Они заключаются в следующем … (Укажите верные утверждения).
А) Проявляется антагонизм между молекулами смешиваемых веществ.
Б) Компоненты смеси стремятся к образованию химических соединений.
В) Наблюдается явление контракции.
Г) Происходит понижение температуры кипения смеси.
Д) Процесс смешивания компонентов сопровождается эндотермическим эффектом.
18. Какие из перечисленных гомогенных систем подчиняются закону идеальных смесей в широком интервале концентраций?
А) Бензол – толуол (70оС).
Б) Бромэтан – йодэтан (30оС).
В) Вода – этанол (85оС).
Г) Вода – серная кислота (90оС).
Д) н-Гексан – н-гептан (30оС)
19. Какие из указанных процессов основаны на фазовом переходе «сублимация»?
А) «Сухая» заморозка продуктов.
Б) Использование брусков льда для охлаждения шампанского.
В) Использование «сухого спирта» в качестве горючего.
Г) Использование твердого СО2 для охлаждения мороженого.
20. Какие из предложенных фазовых переходов сопровождаются выделением тепла?
А) Испарение.
Б) Затвердевание.
В) Сублимация.
Г) Конденсация.
21. Какие из предложенных фазовых переходов сопровождаются поглощением тепла?
А) Осаждение.
Б) Сублимация.
В) Испарение.
Г) Плавление.
22. Оцените верность суждений:
1) Температура фазового превращения - постоянная величина при постоянном давлении; процесс сопровождается изменением энтальпии.
2) Самопроизвольный процесс в изолированной системе всегда сопровождается изменением энтальпии системы.
А) Верно только суждение 1.
Б) Верно только суждение 2.
В) Верны оба суждения.
Г) Неверны оба суждения.
23. Оцените верность суждений:
1) Энтальпия есть мера теплового эффекта химической реакции при постоянной температуре.
2) Самопроизвольно протекающие процессы в одном направлении не являются самопроизвольными в обратном направлении.
А) Верно только суждение 1.
Б) Верно только суждение 2.
В) Верны оба суждения.
Г) Неверны оба суждения.
24. Оцените верность суждений:
1) При любом самопроизвольном процессе Вселенная в целом должна повышать энтропию.
2) Энтропия – функция состояния – есть мера неупорядоченности системы.
А) Верно только суждение 1.
Б) Верно только суждение 2.
В) Верны оба суждения.
Г) Неверны оба суждения.
25. Какой из процессов является самопроизвольным?
А) Ржавление железа.
Б) Скисание молока.
В) Образование озона в верхних слоях атмосферы.
Г) Таяние снега и льда при температуре 200С.
Д) Учеба в университете.
26. В каких из указанных процессов знак изменения энтропии системы отрицателен?
А) Испарение 1 моля жидкого четыреххлористого углерода.
Б) Смешение 10 г этанола с 25 г воды.
В) Осаждение хлорида серебра при осуществлении реакции ионного обмена.
Г) Растворение глюкозы в воде.
Д) Выпадение росы в утренние часы.
27. Оцените верность суждений:
1) Свободная энергия Гиббса (ΔG) в самопроизвольном процессе отрицательна.
2) Свободная энергия Гиббса – мера устойчивости химического соединения.
(А) Верно только суждение 1.
Б) Верно только суждение 2.
В) Верны оба суждения.
Г) Неверны оба суждения.
28. Оцените верность суждений:
1) Если система находится в равновесии, то ΔG = 0
2) Величина ΔG процесса зависит от скорости его протекания.
А) Верно только суждение 1.
Б) Верно только суждение 2.
В) Верны оба суждения.
Г) Неверны оба суждения.
29. Какие определения энтропии правомерны?
А) Энтропия – стрелка времени.
Б) Энтропия – мера хаоса в системе.
В) Энтропия – мера устойчивости вещества.
Г) Энтропия – мера утраченной работоспособности.
 2015-07-04
2015-07-04 4083
4083
