Осмотическое давление растворов низкомолекулярных и высокомолекулярных веществ определяется теоретически уравнением Вант-Гоффа: Росм = CRT
Осмотическое давление можно выразить и по другому: Росм = C/M∙RT
где С - концентрация растворенного вещества в г/л; М - молярная масса растворенного вещества.
Таким образом, 2 уравнение можно использовать для определения молярных масс.
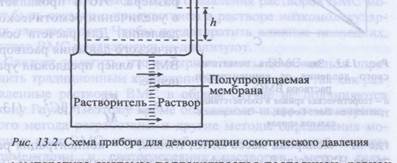
Пример: Рассмотрим систему, в которой раствор, содержащий 20 г гемоглобина в 1 л, помещен в правый сосуд, а чистая вода - в левый, отделенный от правого полупроницаемой мембраной (2). После достижения равновесия высота столба воды в правом сосуде на 7,78 см превышает высоту в левом сосуде. Температура системы поддерживается постоянной, равной 298 К. Какой же будет молярная масса гемоглобина?
Решение:
Для определения М сначала рассчитывают осмотическое давление раствора: 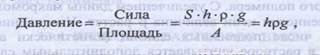
где h - разность высот менисков (0,0778 м); р - плотность раствора (103 кг/м3); g - ускорение свободного падения (9,807 м/с2); А - площадь сечения трубки, м2.
Подставляя численные значения в уравнение, получаем:
Росм = 0,0778 м∙103 кг/м3 ∙9,807 м/с2 = 762,46 кг/м∙с2 = 762,46 н/м2.
Из уравнения (2) определяют молярную массу гемоглобина:

 2015-06-14
2015-06-14 2271
2271








