Изменение концентрации растворенного вещества в поверхностном слое раствора (или вообще на границе раздела фаз) называют адсорбцией. Если вещество поглощается всем объемом поглотителя, то такой процесс называют абсорбцией.
Десорбция – процесс обратный адсорбции.
Адсорбент – вещество, на поверхности которого идет адсорбция.
Адсорбтив – вещество, которое адсорбируется.
Удельная адсорбция – это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы адсорбента.
Удельная адсорбция обозначается буквой (Г). Количественно ее выражают:
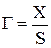
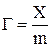
где X – число молей адсорбтива
S – площадь поверхности адсорбента
m – масса адсорбента
Адсорбция на границе раздела жидкость-газ (ж–г).
Количественно ее определяют с помощью уравнения Гиббса.
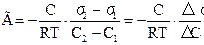
Г – адсорбция – изменение концентрации на поверхности раздела по сравнению с концентрацией в объеме фазы.
Λσ – изменение поверхностного натяжения, соответствующее изменению молярной концентрации вещества ΛC.
R – универсальная газовая постоянная
Из уравнения Гиббса видно, что возможны 2 случая:
1. Если Λσ<0, то Г>0 – положительная адсорбция. Положительную адсорбцию вызывают ПАВ, уменьшающие поверхностное натяжение.
2. Если Λ σ >0, то Г<0 – отрицательная адсорбция. Отрицательную адсорбцию вызывают ПИВ, увеличивающие поверхностное натяжение.
В случае ПАВ величина поверхностной активности зависит от длины углеводородного “хвоста”.
Правило Дюкло-Траубе: удлинение ПАВ на одну группу –CH2– увеличивает поверхностную активность в 3,2–3,5 раза.
Это правило иллюстрируется рисунком:
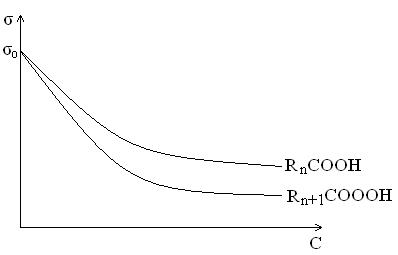
Зависимость поверхностного натяжения σ от концентрации водных растворов ПАВ подчиняется эмпирическому уравнению Шишковского:
σ 0 - σ = 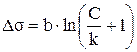
где b и k – эмпирические постоянные, причем b – константа для всего гомологического ряда, а k – увеличивается в 3,2–3,5 раза для каждого последующего члена ряда, в соответствии с правилом Дюкло-Траубе. Согласно уравнению Шишковского с ростом CПАВ поверхностная активность убывает по логарифмическому закону.
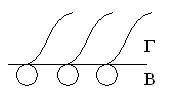
В зависимости от концентрации ПАВ возможны 3 случая расположения молекул на границе водный раствор-газ:
1. При малой концентрации гибкие углеводородные радикалы лежат на поверхности раствора:
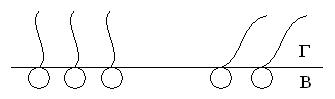
2. При средней концентрации ПАВ появляются отдельные агрегаты:
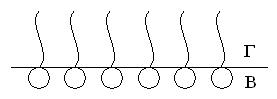
3. При высокой концентрации вся поверхность жидкости покрыта мономолекулярным слоем вертикально ориентированных молекул – “частокол” Лэнгмюра:
 2015-06-14
2015-06-14 2385
2385

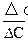 –
–