Скорость смачивания определяется наличием гистерезисов смачивания (задержка продвижения границы жидкости на твердой поверхности.
Разница между углом смачивания при натекании жидкости и углом смачивания при отекании и характеризует гистерезис смачивания. Это явление связано с перемещением капли жидкости по поверхности.
Различают три вида гистерезиса.
1) Кинетический гистерезис это гистерезис, связанный с необходимостью переориентации молекул жидкости мигрирующей по твердой поверхности, т.е. связанный с ее внутренним трением
Приемы уменьшения кинетического гистерезиса:
- УМЕНЬШЕНИЕ ДИНАМИЧЕСКОЙ ВЯЗКОСТИ ЗА СЧЕТ ВВЕДЕНИЯ «ХОРОШЕГО» РАСТВОРИТЕЛЯ.
а) качество растворителя определяется вторым вириальным коэффициентом уравнения Хвггинса.
Уравнение Хаггинса связывает концентрацию разбавленного раствора полимера с вязкостью.
η – динамическая вязкость [па.с].
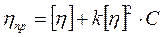 - уравнение Хаггинса;
- уравнение Хаггинса;
Отношение ηуд/С называют приведенной вязкостью (ηпр), т.е. вязкостью, отнесенной к концентрации раствора.
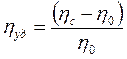
где ηс – вязкость раствора определенной концентрации
η0 – вязкость растворителя.
Определяя ηуд при различной С, можно построить зависимость ηпр от концентрации и экстраполируя прямую к оси ординат, находят значение характеристической вязкости [η], т.е вязкости при бесконечном разбавлении, когда макромолекулы можно рассматривать как изолированные друг от друга.
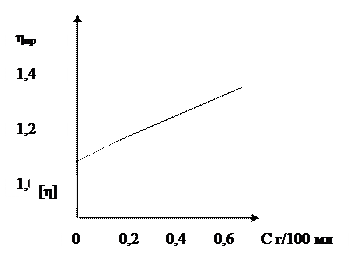
Рисунок – Зависимость приведенной вязкости от концентрации
На основании характеристической вязкости ([ 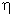 ]), являющейся мерой дополнительных потерь энергии при течении раствора, связанных с вращением и упруговязким деформированием макромолекул в потоке растворителя, и константы Хаггинса, зависящей от степени взаимодействия полимерных цепей с растворителем, можно провести качественную оценку термодинамического сродства растворителей к полимерам.
]), являющейся мерой дополнительных потерь энергии при течении раствора, связанных с вращением и упруговязким деформированием макромолекул в потоке растворителя, и константы Хаггинса, зависящей от степени взаимодействия полимерных цепей с растворителем, можно провести качественную оценку термодинамического сродства растворителей к полимерам.
Большой объем макромолекулярных клубков в хороших растворителях обусловливает их большое гидродинамическое сопротивление, следовательно, чем лучше растворитель, тем больше [ 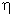 ].
].
Эмпирическая константа Хаггинса
k = 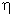 прив[
прив[ 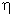 ] / [
] / [ 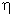 ]2C
]2C
k<0,5 - для систем полимер + хороший растворитель,
k=0,5 – средний растворитель,
k>0,5 – плохой растворитель.
Если растворитель хороший, то энергия взаимодействия между молекулами растворителя и полимера больше чем энергия взаимодействия молекул растворитель-растворитель и больше чем энергия взаимодействия молекул полимер – полимер.
ЕРП>ЕРР;
ЕРП>ЕПП;
Практически это определяется как повышение температуры суспензии.
При среднем растворителе: ЕРП=ЕРР =ЕПП.
Хороший растворитель при повышении температуры может стать плохим и наоборот.
Если:
ЕРП<ЕРР;
ЕРП<ЕПП;
плохой растворитель (нет сольватации - электростатического взаимодействия между частицами (ионами, молекулами) растворенного вещества и растворителя).
 2015-06-14
2015-06-14 1191
1191
