1. Рабочие «горячих» цехов должны пить подсоленную воды, так как в результате повышенного потоотделения осмотическое давление у них:
1) понижается
2) повышается
3) не меняется
4) сначала понижается, затем повышается
2. В 200 г воды растворили Х г вещества, молярная масса которого 92 г/моль. Температура замерзания понизилась на 0.279 °С. Ккр=1.86. Определить Х.
1) 2.76 г
2) 13,8 г
3) 8 г
4) 12,5 г
3. Опишите поведение эритроцитов в 5%-ном растворе NaCl. Каким будет
этот раствор по отношению к плазме крови?
1) гемолиз, гипотоническим
2) плазмолиз, гипотоническим
3) гемолиз, гипертоническим
4) плазмолиз, гипертоническим
4. Изотонический раствор - это:
1) 0,89%-ный раствор NaCl;
2) 8,9%-ный раствор NaCl;
3) 0,089%-ный раствор NaCl;
4) 1,00 %-ный раствор NaCl.
5. Раствор,содержащий 11,6 г вещества в 400г воды,замерзает при температуре -0,93°С (КН2О=1,86град кг/моль).Молярная масса растворенного вещества равна ____г/моль
1)29
2) 58
3)116
4)87
6. Чем объясняется слабительный эффект сульфата магния;
1)осмосом воды в просвет кишечника;
2)диффузией соли в полости кишечника;
3)осмосом соли и воды из полости кишечника?
4)образованием осадков
7. Солевые слабительные средства (сульфаты натрия, магния, карловарская соль) в кишечнике осмотическое давление:
1) уменьшают
2) увеличивают
3) не изменяется
4) сначала уменьшают, затем увеличивают
8. При введении гипертонических растворов наблюдается:
1) осмотический шок
2) осмотический конфликт
3) флуороз
4) ацидоз
9. Температура кипения децимоляльного раствора KCL по сравнению с децимоляльным раствором сахарозы:
1) выше
2) ниже
3) их температуры одинаковы
4) зависит от давления
10. Будут ли изотоническими сантимолярные растворы глюкозы и NaCl?
1) да
2) нет
3) будут осмолярными
4) будут осмоляльными
11. В 2%-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
12. 0,5-ный раствор NaCl является по отношению к плазме крови:
1) гипотоническим
2) гипертоническим
3) изотоническим
4) осмоляльным
13. Осмос – это направленный самопроизвольный переход молекул растворителя через мембрану из:
1) раствора с меньшей концентрацией в раствор с большой концентрацией
2) раствора с большей концентрацией в раствор с меньшей концентрацией
3) зависит от температуры
4) зависит от объема
14. В горах температура кипения воды:
1) ниже, чем на равнине
2) выше, чем на равнине
3) имеет такое же значение, как на равнине
4) зависит от формы сосуда
15. В закрытом сосуде находится 2 стакана: с чистой водой (1) и с водным раствором сахара (2). Через некоторое время…
1) уровень жидкости в стакане (1) понизится, в стакане (2) повысится
2) уровень жидкости в стакане (1) повысится, в стакане (2) понизится
3) уровень жидкости в обоих стаканах не изменится
4) уровень жидкости в обоих стаканах понизится
16. Самопроизвольный распад вещества на ионы при растворении в воде называется:
1) ротация
2) гидратация
3) диссоциация
4) интерференция
17. Только слабые электролиты перечислены в ряду:
1) NH4OH, H2S, H2SO3
2) H2CO3, NaCl, CH3COOH
3) HClO, KOH, MgSO4
4) CaCl2, H2Te, HI
18. Электролитом не является:
1) расплав КОН
2) азотная кислота
3) раствор NaOH
4) этиловый спирт
19. Степень диссоциации в растворах слабых электролитов – это отношение:
1) количества молекул продиссоциированных к общему количеству молекул вещества
2) общего количества молекул вещества к количеству, продиссоциированных молекул
3) активной концентрации вещества к общей концентрации вещества в растворе
4) общей концентрации вещества в растворе к активной концентрации вещества
20. При увеличении концентрации электролита, степень диссоциации:
1) увеличивается
2) уменьшается
3) не зависит от концентрации
4) сначала увеличивается, затем уменьшается
21. Для сильных электролитов понятие «активность ионов» характеризует:
1) степень диссоциации
2) взаимодействие между ионами и растворителем
3) степень гидратации
4) эффективную концентрацию ионов
22. Константа диссоциации слабого электролита зависит от:
1) концентрации
2) разбавления
3) природы вещества и растворителя
4) давления
23. Способность электролита диссоциировать на ионы характеризуется:
1) степенью диссоциации
2) константой растворимости
3) константой Генри
4) константой нестойкости
24. Концентрация иона SO42- в 0,01 м растворе соли Al2(SO4)3:
1) 0,01 м
2) 0,02 м
3) 0,03 м
4) 0,05 м
25. С увеличением ионной силы раствора коэффициент активности иона в уравнении 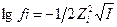 :
:
1) уменьшается
2) увеличивается
3) не изменяется
4) вначале увеличивается, затем остается постоянным
26. Ионная сила плазмы крови человека равна:
1) 0,25 м
2) 0,15 м
3) 0,9 м
4) 0,3 м
27. При некоторых заболеваниях в кровь вводят 0,89% NaCl. Определите массу соли, введенную в организм при вливании 400 мл этого раствора (плотность раствора 1г/ мл).
1) 35,6
2) 0,356
3) 3,56
4) 3,6
28. Массовая доля вещества в растворе показывает сколько:
1) граммов вещества содержится в 100 г раствора
2) граммов вещества содержится в100 мл раствора;
3) граммов вещества содержится в 1000 мл раствора;
4) моль вещества содержится в 1 кг раствора.
29. Для обработки ран используется 3% раствор Н2О2. Какой объем (мл) 30%-ного раствора Н2О2 и воды необходимо взять для приготовления 500 мл 3%-ного раствора (плотность растворов принять равной 1г/мл).
1) 5,00
2) 0,50
3) 50,00
4) 25,00
30. Для приготовления 100 г изотонического раствора необходимо взять:
1) 0,89 г NaCl и 99,11 г воды;
2) 0,89 г NaCl и 98,11 г воды;
3) 8,9 г NaCl и 91,1 г воды;
4) 0,089 г NaCl и 99,911 г воды.
 2015-06-14
2015-06-14 2845
2845








