Для количественного описания свойств растворов используют модель идеального раствора, (в котором нет химического взаимодействия между компонентами). Свойства раствора при данных условиях определяются только концентрацией растворенного вещества, а не их химическим составом. Из реальных растворов только разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
К числу таких свойств относятся:
а) понижение давления пара над раствором;
б) повышение температуры кипения раствора;
в) понижение температуры замерзания раствора;
Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем.
Относительное понижение давления насыщенного пара растворителя (PAo) над раствором (PA) равно молярной доле (NB) растворенного вещества (закон Рауля):
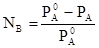 (3)
(3)
При этом DPA= PAo - PA тем значительнее, чем выше концентрация растворенного вещества.
Растворы замерзают при температурах более низких, чем чистые растворители.
Понижение температуры замерзания DTзам пропорционально моляльности раствора (сm) (закон Рауля):
DТзам= К . сm (4),
где К – криоскопическая константа ( 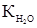 = 1,86)
= 1,86)
Разбавленные растворы кипят при более высоких температурах, чем чистые растворители.
Повышение температуры кипения DTкип пропорционально моляльности раствора (закон Рауля)
DТкип=Е . сm, (5)
где Е – эбулиоскопическая константа (ЕH 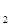 О=0,52)
О=0,52)
Криоскопическая и эбулиоскопическая константы зависят только от природы растворителя.
Уравнения (4) и (5) используются для расчета молярных масс (М) малолетучих неэлектролитов. Если известна масса растворенного вещества m и масса растворителя m1, то молярную массу растворенного вещества М определяют по уравнениям:
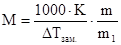 (6);
(6); 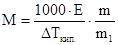 (7);
(7);
Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую перегородку.
Осмотическое давление (Росм.) – это давление, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перегородкой (закон Вант-Гоффа):
Росм= с . R . T (8),
где с – молярная концентрация раствора неэлектролита. Осмотическое давление равно силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку.
Осмотическое давление измеряют в осмометрах (рис. 1). Оно равно давлению столба раствора высотой h. При равновесии внешнее давление уравновешивает осмотическое давление.
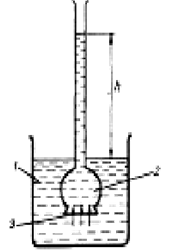
Рис 1. Схема осмометра:
1-вода; 2-раствор; 3-полупроницаемая мембрана.
 2015-06-14
2015-06-14 1364
1364








