Растворы.
1. Типы растворов. Термодинамические факторы процесса растворения. Способы выражения концентрации растворов.
2. Законы идеальных растворов. Растворы неэлектролитов и электролитов.
3. Водные растворы электролитов. Теории кислот и оснований. Сильные и слабые электролиты. Активность. Свойства растворов электролитов.
4. Ионные реакции в растворах. Условия одностороннего протекания реакций обмена.
5. Произведение растворимости. Механизм накипеобразования.
6. Водородный показатель среды, его роль в технологических операциях на флоте. Гидролиз солей.
1. Коровин Н.В. Общая химия. – М.: Высш. шк., 1998. – с.142-148; 201-206; 208-209; 225-238.
2. Ахметов Н.С.Общая и неорганическая химия. – М: Высш. шк., 1998.-с.139-149; 225-231.
Типы растворов. Термодинамические факторы процесса растворения. Способы выражения концентрации растворов.
Растворы – это однородные (гомогенные) системы, состоящие из двух и более компонентов, относительные количества которых могут изменяться в широких пределах.
По агрегатному состоянию растворы бывают твердые, жидкие и газообразные.
По характеру взаимодействия растворяемого вещества с растворителем различают ионные растворы (например, растворы солей, кислот) и молекулярные растворы (например, растворы газов и органических соединений, которые остаются при растворении недиссоциированными).
Согласно современным представлениям о растворах, жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями.
Химические явления в процессе растворения впервые были отмечены Д.И. Менделеевым. Химическое взаимодействие молекул растворителя с частицами растворенного вещества называют сольватацией, а получающиеся при этом соединения – сольватами. Частный случай взаимодействия частиц растворенного вещества с растворителем – водой был назван гидратацией, а продукты взаимодействия (например, H2SO4∙H2O) - гидратами.
Растворение состоит из трех основных физико-химических процессов:
1) разрушение химических и межмолекулярных связей в растворяющихся газах, жидкостях и твердых телах (в том числе и связей в кристаллах), требующих затраты энергии, энтальпия системы при этом увеличивается, DH1>0;
2) химическое взаимодействие растворителя с растворяющимся веществом, связанное с образованием сольватов (гидратов), сопровождающееся выделением энергии, энтальпия системы при этом уменьшается, DH2<0;
3) самопроизвольное перемешивание раствора, связанное с диффузией и требующее затраты энергии, энтальпия системы при этом увеличивается, DH3>0.
Суммарный тепловой эффект процесса растворения равен: DH=DH1+DH2+DH3.
Растворение может быть эндотермическим и экзотермическим.
Растворение протекает самопроизвольно (DG<0) вплоть до насыщения раствора. При этом тепловой эффект процесса растворения (DH) и изменение энтропии при растворении (DS) могут быть и положительными, и отрицательными. (Процесс не может протекать самопроизвольно только тогда, когда DH>0, аDS<0).
Растворение кристаллических веществ часто идет с поглощением теплоты (DH>0) и обычно сопровождается ростом энтропии (DS>0). Самопроизвольному течению процесса растворения кристаллических веществ в воде способствуют высокие температуры.
Растворимость вещества при данных условиях определяется концентрацией насыщенного раствора.
Растворы бывают ненасыщенными, насыщенными и перенасыщенными.
Раствор, в котором устанавливается равновесие между растворением и образованием (осаждением, кристаллизацией, выделением) вещества, называется насыщенным.
Растворение газов – процесс экзотермический, поэтому с повышением температуры растворимость уменьшается. Растворимость X газов в жидкости пропорциональна их парциальному давлению Р над жидкостью (закон Генри):
X = kP (1),
где к – коэффициент пропорциональности (константа Генри). Растворимость жидкости в жидкости обычно увеличивается с повышением температуры. На растворимость оказывает влияние природа как растворителя, так и растворяемого вещества.
Основная характеристика растворов – концентрация.
Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации.
Молярная концентрация с - отношение количества вещества (в молях), содержащегося в системе (например, в растворе), к объему V этой системы. Единица измерения молярной концентрации моль/м 3 (дольная производная, СИ - моль/л). Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают 1М раствор.
Молярная концентрация эквивалентов сэк (нормальная концентрация) -это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л (дольная производная, СИ). Раствор, в одном литре которого содержится один моль вещества эквивалентов, называют нормальным и обозначают 1н.
Моляльность b - отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности моль/кг.
Молярная доля - отношение количества вещества данного компонента (в молях), содержащегося в системе, к общему количеству вещества (в молях). Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн -1).
Массовая доля - отношение массы данного компонента, содержащегося в системе, к общей массе этой системы. Массовая доля может быть выражена в долях единицы, процентах, промилле и миллионных долях. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
Объемная доля - отношение объема компонента, содержащегося в системе (растворе), к общему объему системы. Объемная доля может быть выражена в долях единицы, процентах, промилле и миллионных долях.
Массовая концентрация - отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (раствора). Единица измерения массовой концентрации - кг/м3, кг/дм3, кг/см3, г/дм3 и г/л.
Титр раствора - масса вещества, содержащегося в одном кубическом сантиметре или в одном миллилитре раствора. Единица измерения титра – кг/см3, г/см3, г/мл.
Приготовление растворов различных концентраций лежит в основе всех технологических операций на морском флоте.
Объемы растворов реагирующих веществ обратно пропорциональны их нормальным концентрациям:
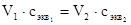 (2),
(2),
где V1 и V2 - объемы растворов реагирующих веществ;
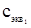 и
и 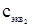 - нормальные концентрации этих растворов.
- нормальные концентрации этих растворов.
Следовательно, для измерения концентрации одного из растворов необходимо знать объемы растворов реагирующих веществ и концентрацию одного раствора. Такой метод определения концентрации растворов принят в объемном анализе. В этом методе, называемом титрованием, производится постепенное прибавление одного раствора к другому до прекращения взаимодействия между растворами. Окончание реакции определяется с помощью индикаторов.
 2015-06-14
2015-06-14 1827
1827
