Гальванический элемент представляет собой электрохимическую систему, состоящую из двух электродов, растворы которых соединены с помощью солевого мостика.
Примером может служить гальванический элемент Даниэля–Якоби (рис. 4.).
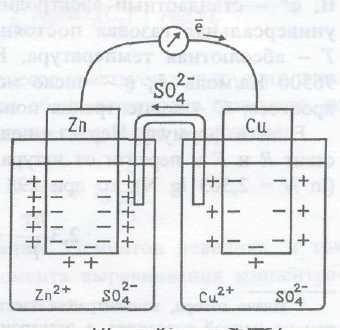
Рис. 4. Схема элемента Даниэля–Якоби
Он состоит из медной пластины, погруженной в раствор CuSO4, и цинковой пластины, погруженной в раствор ZnSO4. Растворы сульфатов цинка и меди соединены между собой солевым мостиком — стеклянной трубкой, заполненной раствором хлорида калия. Солевой мостик препятствует смешиванию растворов, но проводит электрический ток и обеспечивает ионную проводимость между растворами.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
Zn? Zn2+ + 2e
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Cu? Cu2+ + 2e
поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение (?0Zn/Zn2+ = – 0,76 В), чем потенциал медного электрода (?0Cu/Cu2+ = + 0,34 В), поэтому при замыкании внешней цепи, т.е при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместиться вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В тоже время равновесие на медном электроде сместиться влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выравняются потенциалы электродов или не раствориться весь цинк (или не высадиться на медном электроде вся медь).
Итак, при работе элемента Даниэля–Якоби протекают следующие процессы:
1) реакции окисления цинка:
Zn – 2e? Zn2+
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди:
Cu + 2e? Cu0
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
3) движение электронов во внешней цепи;
4) движение ионов в растворе: анионов (SO42–) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем:
Zn + Cu2+ = Cu + Zn2+
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
 Схема гальванического элемента, в том числе и элемента Даниэля–Якоби, записывается в виде:
Схема гальванического элемента, в том числе и элемента Даниэля–Якоби, записывается в виде:
(–) A Zn/Zn2+ // Cu/Cu2+ K(+)слева принято указывать анод
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента.
Или
Электродвижущей силой называется разность потенциалов электродов в разомкнутом гальваническом элементе.
ЭДС всегда является величиной положительной.
Чтобы рассчитать ( но не измерить) величину ЭДС, необходимо вычислить по уравнению Нернста потенциалы обоих электродов и вычесть из потенциала положительного электрода величину более отрицательного потенциала:
ЭДС =?К –?А
Еще в первой части лекции мы с вами говорили о том, что величина электродного потенциала зависит как от природы металла, так и от температуры и концентрации раствора (и других факторов). Так вот уравнение Нернста как раз и выражает зависимость величины электродного потенциала от указанных факторов:
?Me/Men+ =?0Me/Men+ + (RT/nF)·ln[Men+]
В этом уравнении ?Me/Men+ – электродный потенциал металла в растворе, содержащем катионы Меn+, В; ?0Me/Men+ – стандартный электродный потенциал металла, В; R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К); Т – температура, К; F – число Фарадея (единица количества электричества), равное 96500 Кл/моль е; n – число электронов, участвующих в электродном процессе; [Men+] – концентрация ионов металла в растворе, моль/л.
Если в уравнение Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным (ln N = 2,3 lg N), то при 298 К получим:
?Me/Men+ =?0Me/Men+ + 0,059/n ·lg[Men+]
 2015-06-16
2015-06-16 6875
6875








