Все металлы и металлические сплавы за редким исключением в твердом состоянии – тела кристаллические, атомы (ионы) расположены в металлах упорядоченно друг относительно друга на определенных расстояниях в зависимости от природы металла. Эти расстояния называются параметрами кристаллической решетки.
В аморфных телах атомы расположены не упорядоченно, а хаотично.
Металлы если их кристаллизуют обычным способом – поликристаллические тела, состоящие из большого числа мелких, различимых только в микроскоп зерен (10-1–10-6см), различно ориентированных по отношению друг к другу.
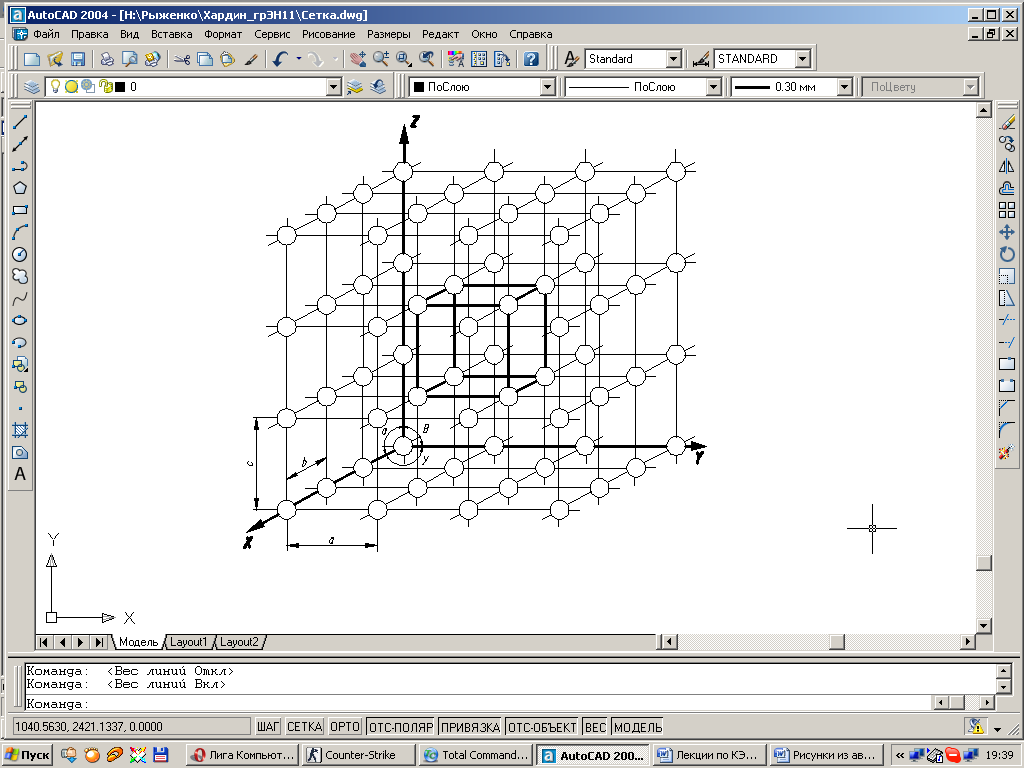 Ближайшие друг к другу атомы образуют контур какой-нибудь геометрической фигуры, например куба (рис. 1.1).
Ближайшие друг к другу атомы образуют контур какой-нибудь геометрической фигуры, например куба (рис. 1.1).
Следовательно, каждое зерно металла состоит из множества таких геометрических тел, называемых элементарными ячейками. В соседних зернах металла эти ячейки ориентированы по-другому.
| Рис. 1.1. Схема кристаллической решетки. |
Что же удерживает атомы в узлах кристаллической решетки, сохраняя природу твердого состояния материала и его прочность.
Известно, что атом любого металла состоит из окружающих его несколько электронных оболочек, несущих отрицательный заряд. Каждая оболочка заполнена строго определенным количеством сильно связанных с атомом электронов и только на последней оболочке, находятся несколько слабосвязанных электронов с атомом. Их число равно валентности металла. С помощью этих электронов атомы в металле устанавливают связи друг с другом. Связь атомов между собой с помощью валентных электронов называется металлической.
Но не все электроны внешней оболочки участвуют в образовании металлической межатомной связи. Часть электронов, покидая ядра своих атомов, уходит в межузельное пространство, образуя электронный «газ», т.е. становятся коллективизированными.
Благодаря коллективизированным электронам металлы обладают электро- и теплопроводностью, металлическим блеском, сверхпроводимостью, термоэлектронной эмиссией, пластической деформацией и другими металлическими свойствами.
Сила связи в металлах определяется силами отталкивания и притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна.
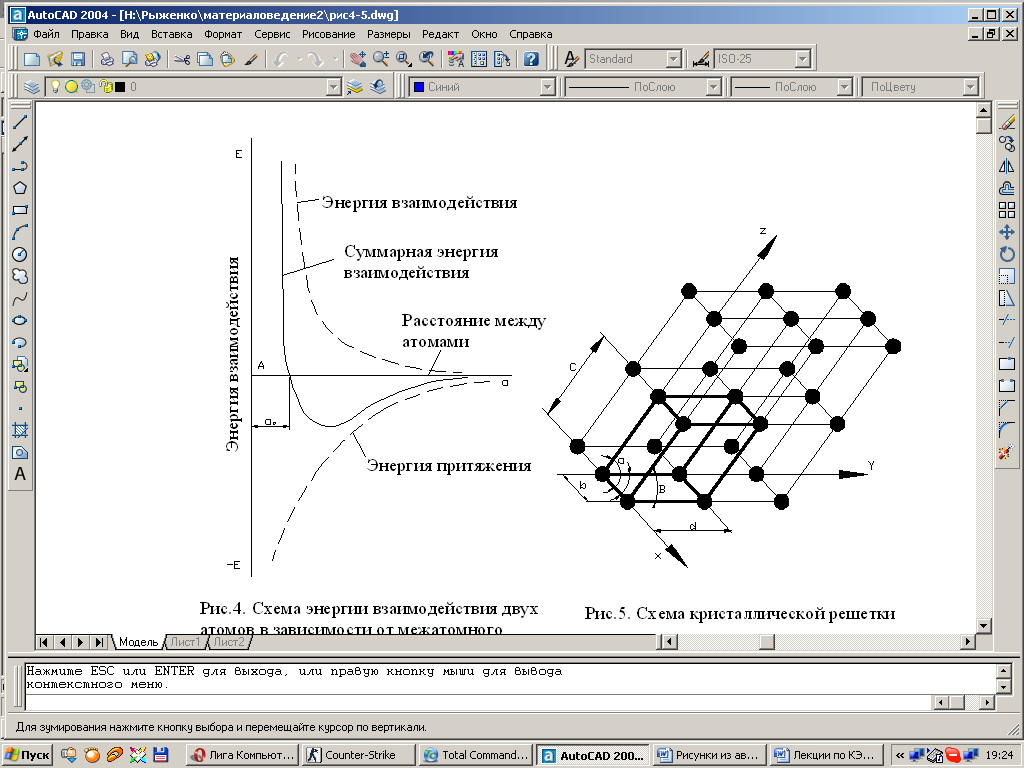 Как видно из рис. 1.2 этому положению соответствует равновесное расстояние a 0. Сближение атомов или удаление их на расстояния меньше или больше a 0, осуществимо лишь при осуществлении определенной работы против силы отталкивания или притяжения. Поэтому атомы в металле располагаются равномерно, образуя правильную кристаллическую решетку.
Как видно из рис. 1.2 этому положению соответствует равновесное расстояние a 0. Сближение атомов или удаление их на расстояния меньше или больше a 0, осуществимо лишь при осуществлении определенной работы против силы отталкивания или притяжения. Поэтому атомы в металле располагаются равномерно, образуя правильную кристаллическую решетку.
Большинство металлов образуют одну из следующих высокосимметричных решеток с
| Рис. 1.2. Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния. |
а, б) кубическую объемную центрированную (ОЦК) – решетку имеют железо при обычных температурных условиях, хром, вольфрам, ванадий, молибден, калий, натрий;
в) кубическую гранецентрированную (ГЦК) – решетку имеют никель, медь, алюминий, свинец, серебро, железо при температурах 911-1392°С и др. металлы;
г) гексагональную плотно упакованную (ГПУ) – решетку имеют магний, цинк, кобальт, цирконий и титан при комнатной температуре.
Для однозначной характеристики элементарной кристаллической решетки, т.е. её параметров, необходимо знать: три ребра (a, b и c) и
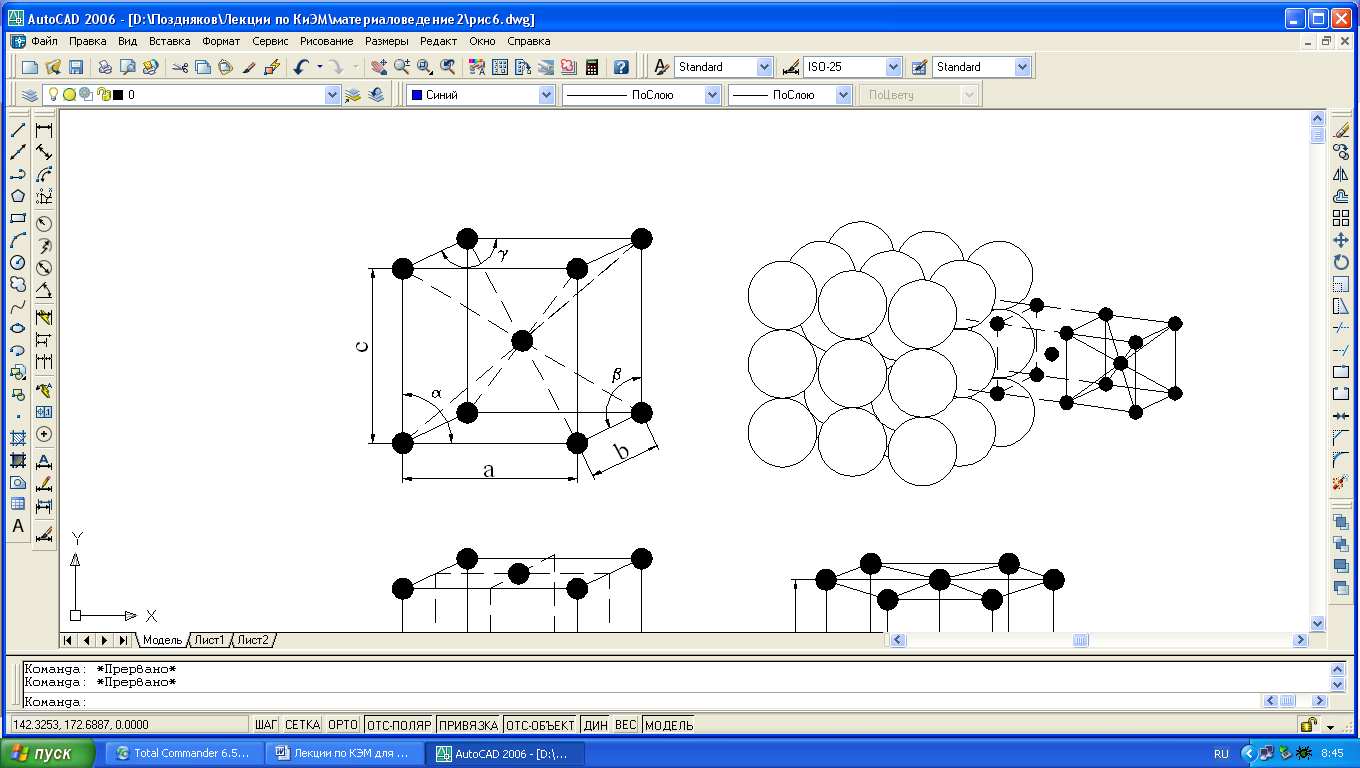
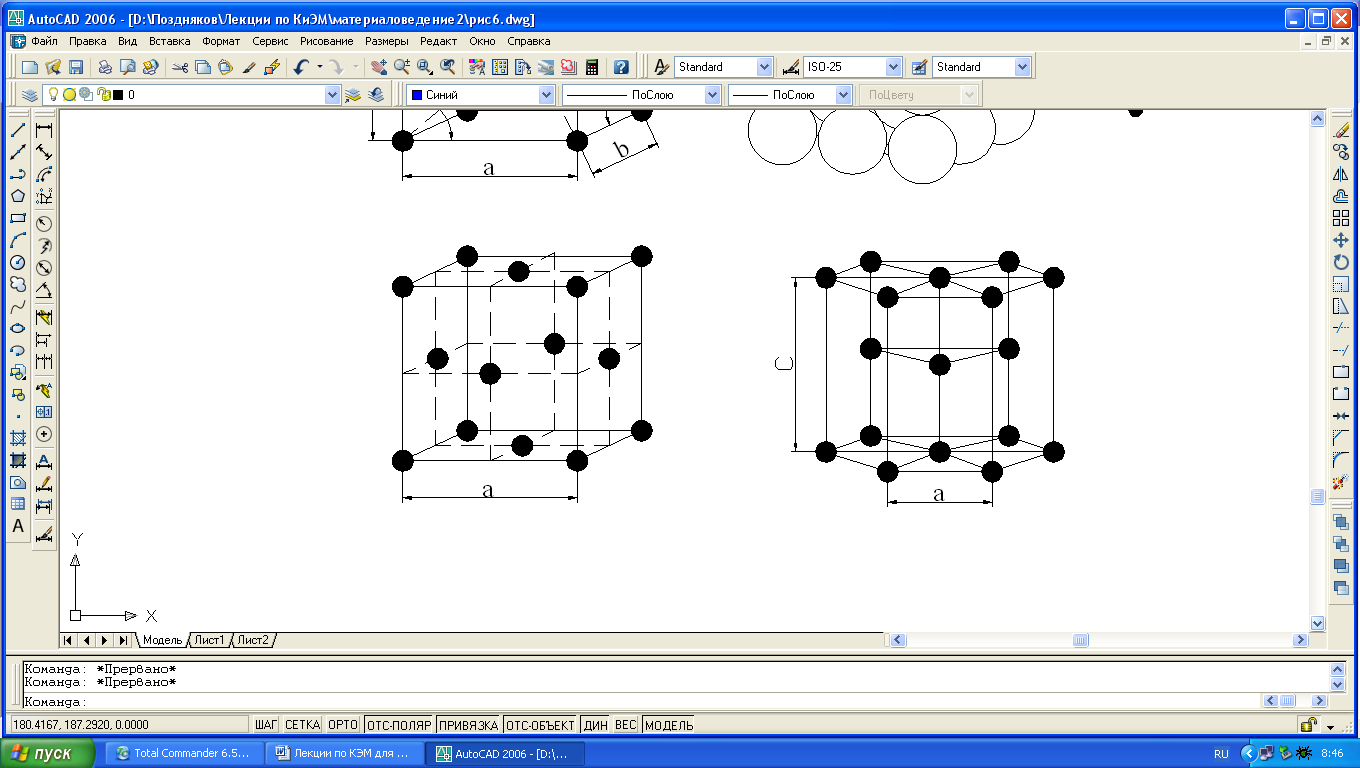
а) б) в) г)
Рис. 1.3. Кристаллические решетки металлов: а и б – кубическая объемноцентрированная (ОЦК); в – кубическая гранецентрированная (ГЦК); г – гексагональная плотноупакованная.
три угла между осями (α, β и γ) (см. рис.1.1). Параметры – расстояния между центрами соседних атомов по избранному направлению и измеряются в нанометрах или Ангстремах А°, причем 1нм=10А°=10-9м.
Как видно, что некоторые металлы в зависимости от температурных условий существуют с различными кристаллическими решетками. Например, железо при температурах до 911°С имеет ОЦК-решетку, выше 911°С и до 1392°С имеет ГЦК-решетку и далее свыше 1392°С вплоть до температуры плавления 1539°С принимает форму ОЦК-решетки.
Способность металла изменять тип кристаллической решетки в зависимости от температуры называется аллотропией или полиморфизмом.
Полиморфные превращения имеют важные значения в технике, благодаря им, оказывается возможным производить термическую обработку сталей и других металлов.
Нетрудно видеть, что плотность атомов в кристаллической решетке по различным плоскостям неодинакова (рис. 1.4).
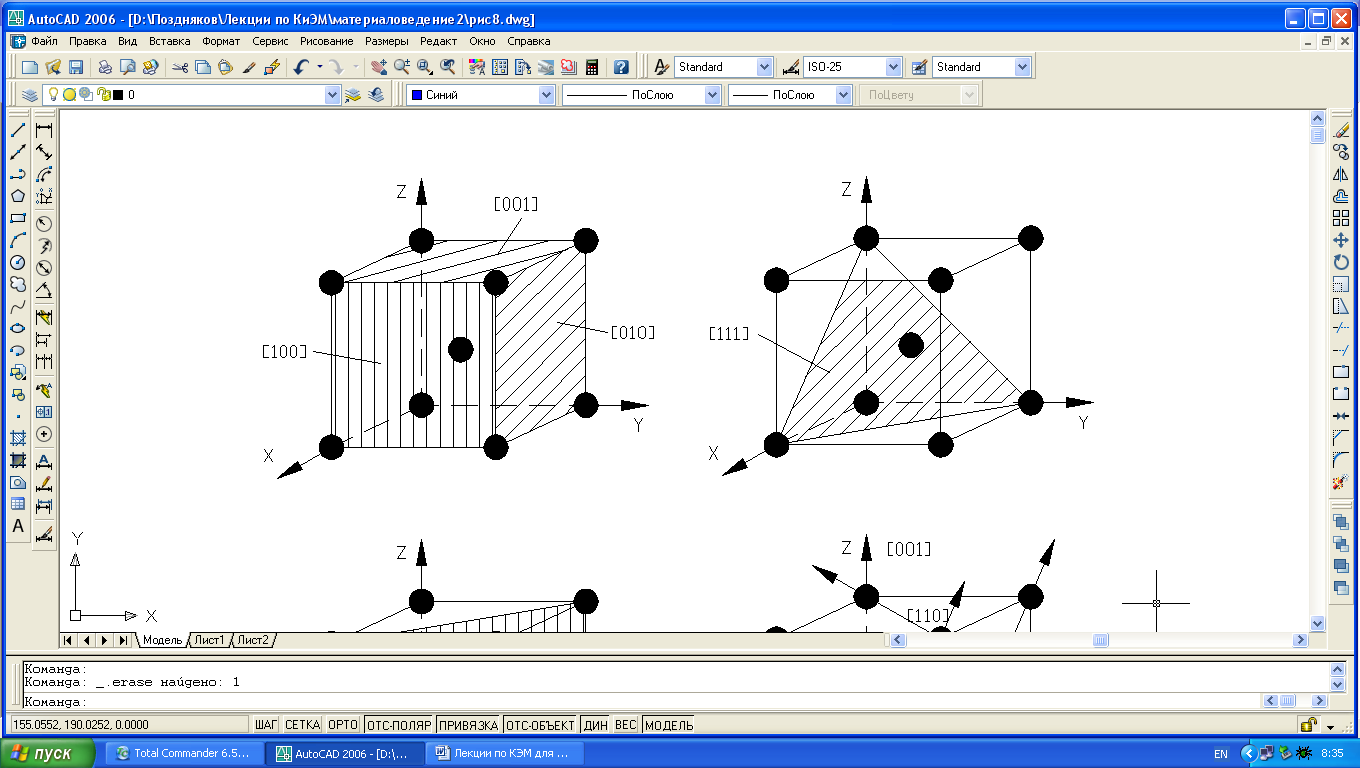
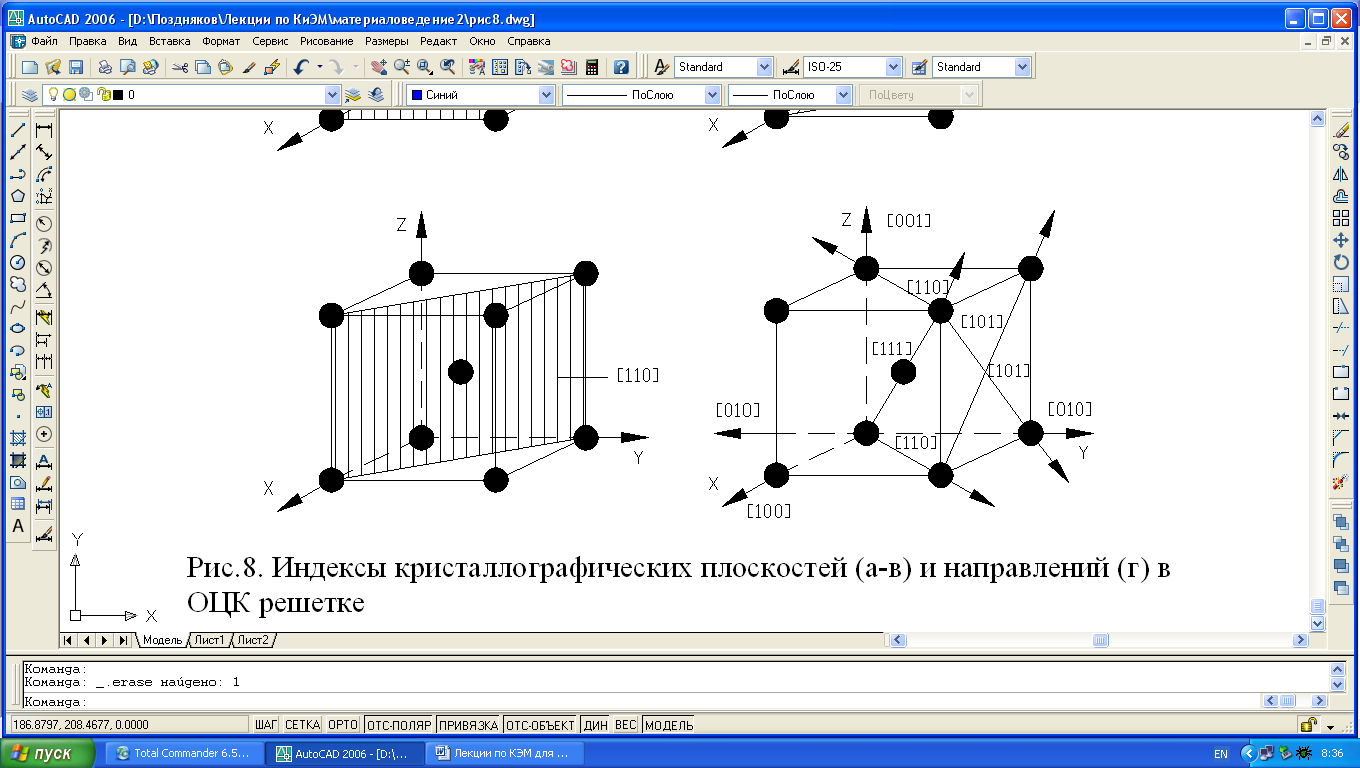
а) б) в) г)
Рис. 1.4. Индексы кристаллографических плоскостей (а-в) и направлений (г) в ОЦК-решетке.
Так плоскость(100) в ОЦК-решетке принадлежит один атом (1/4х4=1), плоскости (110) – 2 атома (1/4х4+1=2), то вследствие неодинаковой плотности в различных плоскостях и направлениях решетки, свойства (химические, физические, механические) каждого монокристалла будут неодинаковы и это называется анизотропией. Следовательно кристалл – тело анизотропное.
Технические металлы – поликристаллические тела, т.е. состоят из большого числа анизотропных кристаллов, которые в большинстве случаев неупорядоченно ориентированы друг к другу. Поэтому свойства во всех направлениях более или менее одинаковы, т.е. поликристаллическое тело псевдоизотропно. Такая мнимая изотропность металла не будет наблюдаться при направленной кристаллизации и значительной холодной деформации.
 2015-06-04
2015-06-04 3446
3446
