Кислородсодержащие кислоты хлора, НСlO4 – хлорная перхлораты НСlO3 – хлорноватая хлораты НСlO2 – хлористая хлориты НСlO – хлорноватистая гипохлориты
Кислородсодержащие кислоты (оксокислоты) хлора
В табл. 16.12 приведены систематические и традиционные названия кислородсодержащих кислот хлора и их солей. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и силакислоты: 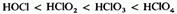
5 - сильные кислоты, причем 6 одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и
Таблица 16.12. Кислородсодержащие кислоты хлора и их анионы

существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только 7 удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием егостепени окисления:
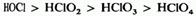
8 - особенно хорошие окислители. Например, кислый раствор 9:
1) окисляет ионы железа (II) до ионов железа (III):
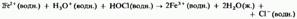
2) на солнечном свету разлагается с образованием кислорода:
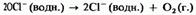
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат 10-ионы:
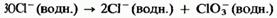
Соли кислородсодержащих кислот хлора
Эти соли обычно более устойчивы, чем сами кислоты. Исключением являются твердые соли хлораты (III), которые детонируют при нагревании и при соприкосновении с горючими материалами. В растворах окислительная способность кислородсодержащих солей хлора тем больше, чем больше в этих соляхстепень окисления хлора. Однако они не являются столь хорошими окислителями, как соответствующие кислоты. Натриевые и калиевые соли 11 имеют важное промышленное значение. Их производство и применения описаны в следующем разделе. Хлорат (V) калия обычно используют для лабораторного получения кислорода, в присутствии оксида 12 в качестве катализатора:
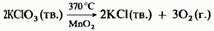
При нагревании этой соли до более низкой температуры в отсутствие катализатора происходит образование 13калия:
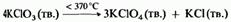
Иодат (V) калия 14 калия 15 сильные окислители, и в качестве окислителей они используются в количественном анализе.
Итак, повторим еще раз 1. Свойства галогенидов различных элементов при перемещении слева направо в пределах одного периода изменяются следующим образом: а) характер химической связи становится все более ковалентным и все менее ионным; б) водные растворы галогенидов становятся все более кислыми из-за гидролиза. 2. Свойства различных галогенидов одного и того же элемента при перемещении к нижней части VII группы изменяются следующим образом: а) характер химической связи галогенидов становится все более ковалентным: б) прочность связи в молекулах галогеноводородов уменьшается; в) кислотность галогеноводородных кислот уменьшается; г) легкость окисления галогеноводородов возрастает. 3. По мере возрастания степени окисления галогена происходят следующие изменения: а) термическая устойчивость его кислородсодержащих кислот возрастает; б) кислотность его кислородсодержащих кислот возрастает; в) окислительная способность его кислородсодержащих кислот уменьшается; г) окислительная способность солей его кислородсодержащих кислот возрастает. 4. Галогениды можно получать прямым синтезом из образующих их элементов. 5. Для получениигалогеноводородов может использоваться реакция вытеснения из галогенидной соли менее летучей кислотой. 6. Аномальные свойства соединений фтора: а) фторид серебра растворим в воде, а фторид кальция нерастворим; б) фтороводород имеет аномально высокие температуры плавления и кипения; в) водный раствор фтороводорода имеет низкую кислотность; г) фтор обнаруживает только одно устойчивое состояние окисления. Другие галогены обнаруживают множество состояний окисления, что объясняется промотированием их16 -электронов на легко доступные 17-орбитали, обладающие низков энергией.
===============================================================================
31. Кислород. Получение и свойства кислорода. Аллотропия кислорода. Озон, его свойства. Озон в природе. Кислород-элемент с порядковым номером 8, его относительная атомная масса=15,999.Находится во втором периоде, в главной подгруппе 6 группы.
В большинстве своих соединений кислород имеет степень окисление -2.В пероксидах водорода и металлов(Н2О2, Na2O, CaO2 и др.)степень окисления кислорода -1.Существует единственное соединение, в котором кислород имеет положительную степень окисления +2-это фтроид кислорода OF2 (фтор-единственный элемент, ЭО которого больше ЭО кислорода, равной 3,5). Обычный кислород О2-газ без цвета и запаха, тяжелее воздуха. В воде малорастворим. Получение. Лабораторные методы получения О2 достаточно многочисленны. 1.Раздожение бертолетовой соли(хлората калия) при нагревании в присутствии оксида марганца(IV) в качестве катализатора: 2KClO3(t)(MnO2)=2KCl + 3O2↑
2.Термическое разложение перманганата калия: 2KMnO4(t)=K2MnO4 + MnO2 + O2↑
3.Термическое разложение нитратов щелочных металлов, например: 2NaNo3(t)=2NaNO2 + O2 4.Каталитическое разложение пероксида водорода: 2H2O2(MnO2)=2H2O + O2↑
5.Взаимодействие пероксидов щелочных металлов с углекислым газом: 2Na2O2 + 2CO2=2NaCO3 + O2↑ 6.Электролиз водных растворов щелочей или солей кислородосодержащих кислот. Сущность происходящих при этом процессов сводится к разложению воды под действием электрического тока: 2H2O(электролиз)=2H2↑ + O2↑
В промышленности кислород получают из воздуха. Химические свойства.
Кислород образует соединения со всеми химическими элементами, кроме легких инертных газов(He, ne, Ar),причем со всеми простыми веществами, кроме фтора, хлора, золота и платиновых металлов, он взаимодействует непосредственно. Во всех реакциях O2играет роль окислителя. При взаимодействии кислорода с простыми веществами -металлами и неметаллами- обычно образуются оксиды; например: 4Li+O2=2LiO2 4P+5O2(60 градусов)=2P2O5 Почти все реакции с участием O2 экзотермичны, за редким исключением; например: N2+O2=2NO-Q Кислород может существовать в виде двух аллотропных видоизменений: кислород О2 и озон О3. Аллотропия (от греч. allos — другой и tropos — образ, способ) связана либо с разным числом атомов в молекуле, либо со строением. При сравнении физических свойств кислорода и озона целесообразно вспомнить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде. Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким, но приятным запахом. Есть отличия и в химических свойствах.
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами. Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании: 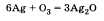 Но в то же время и озон и кислород реагируют с активными металлами, например с калием К. Получение озона происходит по следующему уравнению:
Но в то же время и озон и кислород реагируют с активными металлами, например с калием К. Получение озона происходит по следующему уравнению: 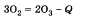 Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека. Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.
Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека. Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.
Химические свойства: озон – сильный окислитель, он окисляет все металлы, в том числе золото – Au и платину – Pt (и металлы платиновой группы). Озон воздействует на блестящую серебряную пластинку, которая мгновенно покрывается черным пероксидом серебра – Аg2О2; бумага, смоченная скипидаром, воспламеняется, сернистые соединения металлов окисляются до солей серной кислоты; многие красящие вещества обесцвечиваются; разрушает органические вещества – при этом молекула озона отщепляет один атом кислорода, и озон превращается в обыкновенный кислород. Атакже большинство неметаллов, переводит низшие оксиды в высшие, а сульфиды их металлов – в их сульфаты: 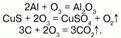 Йодид калия озон окисляет до молекулярного йода:
Йодид калия озон окисляет до молекулярного йода: 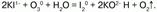 Но с пероксидом водорода Н2О2 озон выступает в качестве восстановителя:
Но с пероксидом водорода Н2О2 озон выступает в качестве восстановителя: 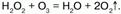 В химическом отношении молекулы озона неустойчивы – озон способен самопроизвольно распадаться на молекулярный кислород:
В химическом отношении молекулы озона неустойчивы – озон способен самопроизвольно распадаться на молекулярный кислород: 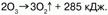
Нахождение в природе: в атмосфере озон образуется во время электрических разрядов. Применение: будучи сильным окислителем озон уничтожает различного рода бактерии, поэтому широко применяется в целях очищения воды и дезинфекции воздуха, используется как белящее средство.
================================================================================
32). Пероксид водорода, его строение и свойства.
Пероксид водорода H2O2 Молекула H2O2 неплоская, имеет строение H−O−O−H с σ-связью O−O на ребре и связями H-O на плоскостях двугранного угла:
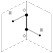 молекула пероксида водорода молекула пероксида водорода | Степень окисления кислорода равна −I, валентность атома O равна 2. Группу -O-O- называют пероксогруппой. Пероксид водорода H2O2 - бесцветная жидкость, неограниченно смешивается с водой. |
На свету и под действием катализаторов (MnO2) легко разлагается (при нагревании - со взрывом): 2H2O2 = 2H2O + O2↑ Известны производные H2O2: Na2O2 - пероксид натрия BaO2 - пероксид бария Пероксиды при нагревании выделяют кислород: 2BaO2 = 2BaO + O2 реагируют с углекислым газом: 2Na2O2 + 2CO2 = 2 Na2CO3 + O2 (реакция используется для регенерации воздуха).
Пероксиды проявляют сильные окислительные свойства (O−I → O−II): 4H2O2 + PbS(т) = 4H2O + PbSO4↓ Na2O2(т) + 2H2SO4 + 2KI = 2H2O + I2↓ + Na2SO4 + K2SO4 и умеренные восстановительные свойства (O−I → O0): 2H2O2 + Ca(ClO)2 = CaCl2 + 2H2O + 2O2↑
5Na2O2(т) + 8H2SO4 + 2KMnO4 = 5O2↑ + 8H2O + 2MnSO4 + 5Na2SO4 + K2SO4 Получение H2O2: BaO2 + 2HCl(конц., хол.)= BaCl2 + H2O2 Пероксиды применяются как отбеливатели текстиля, бумаги, кож, жиров и минеральных масел, окислители ракетного топлива, реагенты в органическом синтезе, при осветлении картин старых мастеров (красочный слой, потемневший из-за перехода белил (гидроксокарбоната свинца в черный PbS) осветляют переводом в белый PbSO4). В промышлености пероксид водорода получают в основном электрохимическими методами, например, анодным окислением растворов серной кислоты или гидросульфата аммония с последующим гидролизом образующейся при этом пероксодвусерной кислоты H2S2O8. Происходящие при этом процессы можно выразить схемой: 2H2SO4 = H2S2O8 + 2H+ + 2e–; H2S2O8 + 2H2O = 2H2SO4 + H2O2
В пероксиде водорода атомы водорода ковалентно связаны с атомами кислорода, между которыми также осуществляется простая связь. Строение пероксида водорода можно выразить следующей структурной формулой:H—O—O—H. Молекулы H2O2 обладают значительной полярностью, что является следствием их пространственной структуры. В молекуле пероксида водорода связи между атомами водорода и кислорода полярны (вследствие смещения общих электронов в сторону кислорода). Поэтому в водном растворе под влиянием полярных молекул воды пероксид водорода может отщеплять ионы водорода, т. е. он обладает кислотными свойствами. Пероксид водорода — очень слабая двухосновная кислота (K1 = 2,6•10–12); в водном растворе она распадается, хотя и в незначительной степени, на ионы: H2O2 <—> H+ + HO2– Диссоциация второй ступени HO2– <—> H+ + O22– практически не протекает. Она подавляется присутствием воды — вещества, диссоциирующего с образованием ионов водорода в большей степени, чем пероксид водорода. Однако при связывании ионов водорода (например, при введении в раствор щелочи) диссоциация по второй ступени происходит.
=================================================================================
 2015-06-05
2015-06-05 10646
10646
