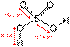 Серная кислота (H2SO4) сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях - тяжёлая маслянистая жидкость без цвета и запаха.
Серная кислота (H2SO4) сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях - тяжёлая маслянистая жидкость без цвета и запаха.
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель; окисляет HI и частично HBr до свободных галогенов, углерод до CO2,серу — до SO2, окисляет многие металлы (Cu, Hg, исключение - золото и платина). При этом концентрированная серная кислота восстанавливается до SO2, например[2]:
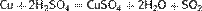
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ[2].
|
|
|
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например[2]:
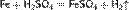
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
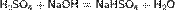
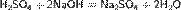
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:

На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
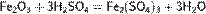
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадоксульфата бария, нерастворимый в воде и кислотах, например[3]:
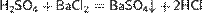
Ниже приведены реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия (V):
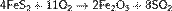
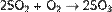
Нитрозный метод получения серной кислоты:
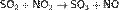
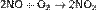
При реакции SO3 с водой выделяется огромное количество теплоты, и серная кислота начинает закипать с образованием трудноулавливаемой аэрозоли:
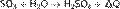
Поэтому SO3 смешивают с концентрированной серной кислотой, получая олеум, который далее разбавляется до нужной концентрации.
================================================================================= 34). Азот. Свойства азота. Соединения азота с водородом.
Азот (от греч. azoos - безжизненный, лат. Nitrogenium), N, химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса. Получение: в промышленности азот получают из воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (–195,8°C), чем другого компонента воздуха — кислорода (–182,9°C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в сосудах Дьюара. В лаборатории чистый («химический») азот получают добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:
|
|
|
NaNO2 + NH4Cl = NaCl + N2 + 2H2O. Можно также нагревать твердый нитрит аммония: NH4NO2 = N2 + 2H2O. В химическом отношении азот довольно инертный газ из-за прочной ковалентной связи, атомарный же азот химически очень активен. Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид:
6Li + N2 = 2Li3N С повышением температуры активность молекулярного азота увеличивается. При взаимодействии азота с водородом при нагревании, повышенном давлении и присутствии катализатора образуется аммиак: N2 + 3H2 = 2NH3 С кислородом азот соединяется только в электрической дуге с образованием оксида азота (II):
N2 + O2 = 2NO\ Азота способен образовывать химические соединения, находясь во всех степенях окисления от +5 до -3. Соединения в положительных степенях окисления азот образует с фтором и кислородом, причем в степенях окисления больше +3 азот может находиться только в соединениях с кислородом. Соединения, в которых имеет степень окисления - 3, называются нитридами. От азота производятся следующие водородные соединения: 1) НN3 − азотистоводородная кислота. Она крайне неустойчива (взрывчата). Ее соли называются азидами. 2) NН3 − аммиак. Может присоединять один ион водорода, образуя при этом положительный ион [NН4]+. Соответственно этому аммиак образует с кислотами соли [NН4]Х − соли аммония. Водные растворы аммиака благодаря наличию в них равновесия: NH3 + НОH ↔ [NН4]+ + ОН— имеют щелочную реакцию. Однако сам по себе аммиак является не основанием (так как он не имеет гидроксильной группы), а ангидрооснованием. 3) N2Н4 − гидразин. Это соединение также способно образовывать с кислотами соли, а именно соли гидразония.
=================================================================================
35). Азотистая и азотная кислоты и их роли. Роль азота в природе. Азотные удобрения.
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
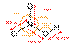
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
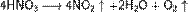
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией). Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
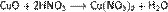
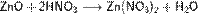
б) с основаниями:
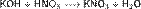
в) вытесняет слабые кислоты из их солей:
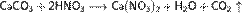
При кипении или под действием света азотная кислота частично разлагается:
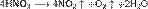
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: а) с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3
|
|
|
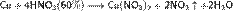
Разбавленная HNO3
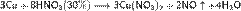
б) с металлами, стоящими в ряду напряжений левее водорода:
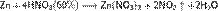
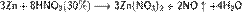
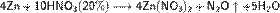
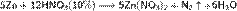
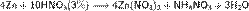
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
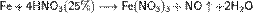
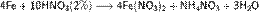
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
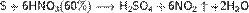

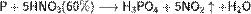
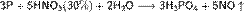
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды иликарбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется. Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
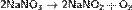
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
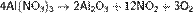
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
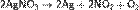
г) нитрат аммония:
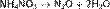
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
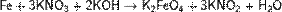
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
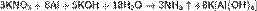
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитритыгораздо более устойчивы, чем HNO2, все они токсичны.
|
|
|
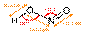
В водных растворах существует равновесие:
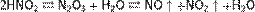
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
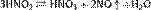
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD=4,6·10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
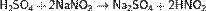
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор,перманганат калия) окисляется в азотную кислоту:
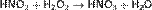
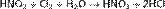
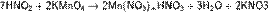
В то же время она способна окислять вещества, обладающие восстановительными свойствами:
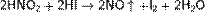
Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:
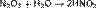
Также она получается при растворении в воде оксида азота (IV) NO2:
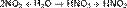
Наиболее распространены следующие азотные удобрения. Мочевина (карбомид) - CO(NH2)2, Сульфат аммония (сернокислый аммоний) - (NH4)2SO4, Аммиачная селитра (азотнокислый аммоний, нитрат аммония) - NH4 NO3 Огромное значение азотных удобрений в увеличении урожайности сельскохозяйственных культур обусловливается исключительно важной ролью азота в жизни растений. Азот входит в состав белков, являющихся главной составной частью цитоплазмы и ядра клеток, в состав нуклеиновых кислот, хлорофилла, ферментов, фосфатидов, большинства витаминов и других органических азотистых соединений, которые играют важную роль в процессах обмена веществ в растении.
Основным источником азота для растений являются соли азотной кислоты (нитраты) и соли аммония. В естественных условиях питание растений азотом происходит путем потребления ими аниона NO3- и катиона NH4+, находящихся в почвенном растворе и в обменно-поглощенном почвенными коллоидами состоянии. Поступившие в растения минеральные формы азота проходят сложный цикл превращения, в конечном итоге включаясь в состав органических азотистых соединений — аминокислот, амидов и, наконец, белка.
=================================================================================
36). Фосфор.Свойства фосфора. Фосфорная кислота и ее соли. Фосфорные удобрения
Фосфор – химический элемент с атомным номером 15. Располагается в V группе периодической системы Д.И. Менделеева. Химическая формула фосфора Р. Своё название фосфор получил от греческого phosphoros, что означает "светоносный". Фосфор довольно распространён в земной коре. Его содержание составляет 0,08-0,09% всей массы земной коры. А в морской воде фосфора содержится 0,07 мг/л. Фосфор имеет высокую химическую активность, поэтому в свободном состоянии не встречается. Но зато он образует почти 190 минералов. Фосфор называют элементом жизни. Он содержится в зелёных растениях, животных тканях, белках и других важнейших химических соединения
Взаимодействие с простыми веществами Фосфор легко окисляется кислородом:
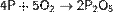 (с избытком кислорода)
(с избытком кислорода)
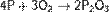 (при медленном окислении или при недостатке кислорода)
(при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
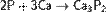
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
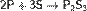
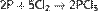
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
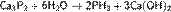
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — РH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
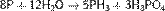
Взаимодействие со щелочами[
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
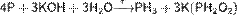
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
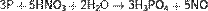
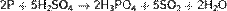
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
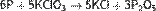
Фосфор образует большое число различных оксидов и кислот. Среди них наиболее устойчивыми являются оксиды фосфора (III) и (V). Оксидфосфора (III) – Р2О3. Оксид фосфора (V), или фосфорный ангидрид P2O5 Получение: 4Р + 3О2 → 2Р2О3; 4Р + 5О2 → 2Р2О5
Химические свойства Р2О5: белое, сильно гигроскопичное вещество. Проявляет свойства кислотного оксида. Очень устойчив и не проявляет окислительных свойств. P2O5 + 6NaOH → 2Na3PO4 + 3H2O; 3CaO + P2O5 → Ca3(PO4)2 Фосфорная кислота (ортофосфорная) H3PO4.
Прозрачные кристаллы, tпл = 42,3 оС, с водой смешивается в любых соотношениях. Электролитсредней силы, диссоцирует ступенчато:
H3PO4↔H+ + H2PO4—; H2PO4—↔H+ + HPO42-; HPO42-↔ Н+ + PO43-; Н3РО4 + 3КОН → К3РО4 +3Н2О; 2Н3РО4 + 3К2О → 2К3РО4 + 3Н2О Cоли ортофосфорной кислоты (фосфаты и гидрофосфаты). Являясь трехосновной кислотой, H3PO4 образует три вида солей. Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты растворим в воде только дигидрофосфат кальция
Са(H2PO4)2. Фосфорные удобрения. Фосфор повышает засухо- и морозоустойчивость, способствует накоплению ценных веществ в растениях. Удобрениями служат как природные фосфорные руды, так и продукты их химической переработки. Качество фосфорных удобрении характеризуется содержанием усвояемого Р в пересчете на Р2О5.Стандартным считается удобрение, содержащее 18,9% Р2О5. Сырьем для получения служат природные фосфорные руды – фосфориты и апатиты. Фосфоритная мука – это природный измельченный фосфорсодержащий минерал. Производство состоит из стадий дробления, сушки и размола фосфоритов.Суперфосфат простой получается разложением природных фосфатов серной кислотой. Простой суперфосфат содержит от 14 до 21% усвояемого Р2О5:
4Ca5(PO4)3F + 14H2SO4 + 13H2O → 6Ca(H2PO4)2·H2O + 14CaSO4·0,5H2O + 4HF,
Ca5(PO4)3F получают из кальцийфторапатита Ca5(PO4)3·CaF2 Суперфосфат двойной отличается меньшим содержанием балласта и содержит в 2–3 раза больше усвояемого Р2О5.
=================================================================================
37). Углерод и его свойства. Аллотропные модификации углерода. Оксиды углерода, угольная кислота, карбонаты.
Углеро́д (химический символ — C, лат. Carboneum) — химический элемент четырнадцатой группы (по устаревшей классификации — главной подгруппы четвёртой группы), 2-го периода периодической системы химических элементов. порядковый номер 6, атомная масса — 12,0107 При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
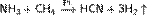
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. Получен селенид углерода CSe2. С большинством металлов углерод образуеткарбиды, например:
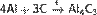
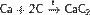
Важна в промышленности реакция углерода с водяным паром:
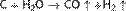
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
Физические свойства Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Кристаллический углерод Алмаз Графит Карбин Аморфный углерод Активированный уголь Древесный уголь Ископаемый уголь: антрацит и др. Кокс каменноугольный, нефтяной и др. Наиболее известны два оксида углерода: Монооксид углерода CO (угарный газ)
Диоксид углерода CO2 (углекислый газ) Менее известны: Диоксид триуглерода C3O2 Меллитовый ангидрид C12O9 Гексагидроксибензол трисоксалат C12O12 Угольная кислота H2CO3 – соединение непрочное, существует только в водных растворах. Большая часть растворенного в воде углекислого газа находится в виде гидратированных молекул CO2, меньшая – образует угольную кислоту. Водные растворы, находящиеся в равновесии с CO2 атмосферы, являются кислыми: [CO2] = 0,04 М и рН ≈ 4.
Угольная кислота – двухосновная, относится к слабым электролитам, диссоциирует ступенчато (К1 = 4, 4 ∙ 10−7; К2 = 4, 8 ∙ 10−11). При растворении CO2 в воде устанавливается следующее динамическое равновесие H2O + CO2 ↔ CO2 ∙ H2O ↔ H2CO3 ↔ H+ + HCO3−
↓↑; H+ + CO32−; При нагревании водного раствора углекислого газа растворимость газа понижается, CO2 выделяется из раствора, и равновесие смещается влево.
Будучи двухосновной, угольная кислота образует два ряда солей: средние соли (карбонаты) и кислые (гидрокарбонаты). Большинство солей угольной кислоты бесцветны. Из карбонатов растворимы в воде лишь соли щелочных металлов и аммония.
В воде карбонаты подвергаются гидролизу, и поэтому их растворы имеют щелочную реакцию: Na2CO3 + H2O ↔ NaHCO3 + NaOH. Дальнейший гидролиз с образованием угольной кислоты в обычных условиях практически не идет. Растворение в воде гидрокарбонатов также сопровождается гидролизом, но в значительно меньшей степени, и среда создается слабощелочная (рН ≈ 8). Карбонат аммония (NH4)2CO3 отличается большой летучестью при повышенной и даже при обычной температуре, особенно в присутствии паров воды, которые вызывают сильный гидролиз. Сильные кислоты и даже слабая уксусная кислота вытесняют из карбонатов угольную кислоту: K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑. В отличие от большинства карбонатов, все гидрокарбонаты в воде растворимы. Они менее устойчивы, чем карбонаты тех же металлов и при нагревании легко разлагаются, превращаясь в соответствующие карбонаты: 2KHCO3 = K2CO3 + H2O + CO2↑;; Ca(HCO3)2 = CaCO3 + H2O + CO2↑.; Сильными кислотами гидрокарбонаты разлагаются, как и карбонаты: KHCO3 + H2SO4 = KHSO4 + H2O + CO2; Из солей угольной кислоты наибольшее значение имеют карбонат натрия (сода), карбонат калия (поташ), карбонат кальция (мел, мрамор, известняк), гидрокарбонат натрия (питьевая сода) и основной карбонат меди (CuOH)2CO3 (малахит).
================================================================================
38). Кремний и его свойства. Оксиды кремния, кремниевые кислоты, силикаты
Кре́мний — элемент главной подгруппы четвёртой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Обозначается символом Si (лат. Silicium), неметалл. «Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния:
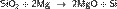
При этом образуется бурый порошок аморфного кремния» Химические свойства
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
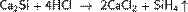
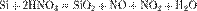
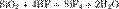
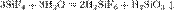
Для травления кремния могут использоваться водные растворы щёлочей. Травление кремния в щелочных растворах начинается при температуре раствора более60 °C.
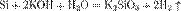
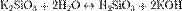
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой. Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:
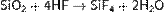
и плавиковой кислотой:
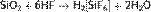
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
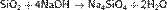
метасиликат кальция:
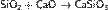
или смешанный силикат кальция и натрия:
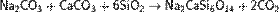
Из кремниевых кислот известны: метакремниевая H2SiO3, ортокремниевая H4SiO4, дикремниевые H2Si2O5 и H10Si2O9, пирокремниевая H6Si2O7 и поликремниевые nSiO2•mH2O. Соответствующие соли называют силикатами (метасиликаты, ортосиликаты и др.).
Все поликремниевые кислоты малорастворимы в воде. В воде образуют коллоидные растворы по общей схеме реакции:
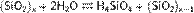
Образовавшаяся неустойчивая ортокремниевая кислота вступает в реакции поликонденсации:
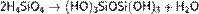
в результате чего образуются сложные линейные, разветвлённые и смешанные структуры.
Изоэлектрическая точка поликремниевых кислот находится в интервале pH 2,0-3,0, в котором поликонденсация идёт с минимальной скоростью. Кремниевые кислоты являются слабыми. Для метакремниевой кислоты H2SiO3 константы диссоциации K1 = (2-3)•10-10, K2 ~ 10-11÷-13, для ортокремниевой H4SiO4 K1 = 2•10-10, K2 = K3 = K4 = 2•10-12.
Кремниевые кислоты растворяются в растворах и расплавах щелочей, образуя силикаты:
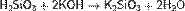
Ортокремниевая кислота способна образовывать ортосиликаты-эфиры в общем случае имеющие вид R1R2R3R4SiO4, где R1-4 - органические радикалы, как правило, являющиеся спиртовыми остатками. Известным массовым продуктом является тетраэтилортосиликат состава Si(C2H5O)4
Получение[править | править вики-текст]
Растворы кремниевых кислот получают растворением аморфного диоксида кремния в воде, действием сильных кислот на растворимые силикаты натрия или калия:
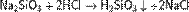
гидролизом хлорсиланов:
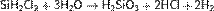
а также методами электродиализа и ионного обмена.
=================================================================================
39). Природа металлического строения и структура металлов. Общие физические и химические свойства металлов
 2015-06-05
2015-06-05 2974
2974
