При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe. С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C. В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+. Ка́дмий Физические свойства Кадмий — серебристо-белый мягкий металл с гексагональной решёткой. Если кадмиевую палочку изгибать, то можно услышать слабый треск — это трутся друг о друга микрокристаллы металла (так же трещит и пруток олова).
Химические свойства В соответствии с внешней электронной конфигурацией атома 4d10 5s2 валентность Кадмия в соединениях равна 2. На воздухе Кадмий тускнеет, покрываясь тонкой пленкой оксида CdO, которая защищает металл от дальнейшего окисления. При сильном нагревании на воздухе Кадмий сгорает в оксид CdO - кристаллический порошок от светло-коричневого до темно-бурого цвета, плотность 8,15 г/см3; при 700°C CdO возгоняется, не плавясь. Кадмий непосредственно соединяется с галогенами; эти соединения бесцветны; CdCl2, CdBr2 и CdI2очень легко растворимы в воде (около 1 части безводной соли в 1 части воды при 20 °C), CdF2 растворим труднее (1 часть в 25 частях воды). С серой Кадмий образует сульфид CdS от лимонно-желтого до оранжево-красного цвета, нерастворимый в воде и разбавленных кислотах. Кадмий легко растворяется в азотной кислоте с выделением оксидов азота и образованием нитрата, который дает гидрат Cd(NOa)2·4H2O. Из кислот - соляной и разбавленной серной Кадмий медленно выделяет водород, при выпаривании растворов из них кристаллизуются гидраты хлорида 2CdCl2·5H2O и сульфата 3CdSO4·8H2O. Растворы солей Кадмия имеют кислую реакцию вследствие гидролиза; едкие щелочи осаждают из них белый гидрооксид Cd(OH)2, нерастворимый в избытке реактива; впрочем, при действии концентрированных растворов щелочи на Cd(OH)2 были получены гидрооксокадмиаты, например Na2[Cd(OH)2]. Катион Cd2+ легко образует комплексные ионы с аммиаком [Cd(NH3)4]2+ и с цианом [Cd(CN)4]2-и [Cd(CN)6]4-. Известны многочисленные основные, двойные и комплексные соли Кадмия. Соединения Кадмия ядовиты; особенно опасно вдыхание паров его оксида. Ртуть. Физические свойствa Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы — амальгамы. Химические свойства Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые. В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:Hg22+ =Hg+Hg2+
подщелачивании:Hg22+ + 2OH- = Hg + HgO + H2O; добавлении лигандов, стабилизирующих степень окисления ртути +2. Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся. На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I): Hg + Hg(NO3)2 = Hg2(NO3)2; В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется: 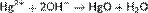 В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса:
В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса: 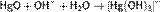 Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4[13][14].
Свойства металлической ртути[править Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке[15]: 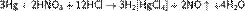
и азотной кислоте: 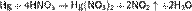
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути: 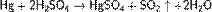
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом: 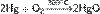
При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ. 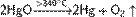
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II): 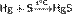
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия: 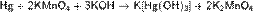
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
=================================================================================
44). Элемент побочной подгруппы VI группы периодической системы. Строение электронной оболочки 3d54s1 В атоме хрома наблюдается «проскок» электрона: один электрон с внешнего энергетического уровня переходит на d - подуровень предпоследнего уровня, но общее число валентных электронов равно шести. В соответствии с электронным строением атома, хром может проявлять в соединениях различные степени окисления - от +1 до +6; из них наиболее устойчивы соединения хрома со степенями окисления +2, +3, +6. Хром Природные стабильные изотопы: 50Cr (4,31%), 52Cr (87,76%), 53Cr (9,55%) и 54Cr (2,38%). Из искусственных радиоактивных изотопов наиболее важен 51Cr (период полураспада T½ = 27,8 суток), который применяется как изотопный индикатор. Распространение Хрома в природе. Среднее содержание Хрома в земной коре (кларк) 8,3·10-3%. Этот элемент, вероятно, более характерен для мантии Земли, так как ультраосновные породы, которые, как полагают, ближе всего по составу к мантии Земли, обогащены Хромом (2·10-4%). Хром образует массивные и вкрапленные руды в ультраосновных горных породах; с ними связано образование крупнейших месторождений Хрома. В основных породах содержание Хрома достигает лишь 2·10-2%, в кислых - 2,5·10-3%, в осадочных породах (песчаниках) - 3,5·10-3%, глинистых сланцах - 9·10-3%. Хром - сравнительно слабый водный мигрант; содержание Хрома в морской воде 0,00005 мг/л. 2. Физические свойства хрома. Хром представляет собой твердый, пластичный, довольно тяжелый, ковкий металл серо-стального цвета. Кипит при 24690С, плавится при 1878± 220С. Обладает всеми характерными свойствами металлов - хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имеет блеск, присущий большинству металлов. И в то же время, устойчив к коррозии на воздухе и в воде. Примеси кислорода, азота и углерода, даже в самых малых количествах, резко изменяют физические свойства хрома, например, делая его очень хрупким. Но, к сожалению, получить хром без этих примесей очень трудно. Структура кристаллической решетки - объемноцентрированная кубическая. Особенностью хрома является резкое изменение его физических свойств при температуре около 37°С. Это аномальное явление ученым не удалось объяснить достоверно до сих пор. Дело в том, что в этой температурной точке внутреннее трение хрома достигает максимума, а модуль упругости падает до минимальных значений. 3. Химические свойства хрома. В зависимости от температур меняется и химическая активность хрома. Так при небольших температурах хром мало активен и взаимодействует только со фтором. С увеличением температуры от 6000C, начинает взаимодействовать с галогенами, серой, азотом, кремнием, бором, углеродом, кислородом. Реакция с кислородом протекает сначала довольно активно, но через некоторое время резко замедляется, так как поверхность покрывается тонкой чрезвычайно устойчивой пленкой, препятствующему дальнейшему окислению. Это явление получило название – пассивирование. Хром пассивируется холодными концентрированными H2SO4 и HNO3, однако при сильном нагревании он растворяется в этих кислотах: 2Cr + 6H2SO4(конц.) = Cr2(SO4)3 + 3SO2 + 6H2O Cr + 6HNO3(конц.) = Cr(NO3)3 + 3NO2 + 3H2O Хром и его соединения Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов. При высокой температуре хром горит в кислороде, образуя оксид Сг2Оз. 4Сг + ЗО2 = 2Сг2О3 Металлический хром при нагревании реагирует с галогенами, галогено-водородами, серой, азотом, фосфором, углём, кремнием и бором. Cr + 2HF = CrF2 + Н2 2Cr + N2 = 2CrN 2Cr + 3S = Cr2S3 Cr + Si = CrSi В азотной и концентрированной серной кислотах хром пассивируется, покрываясь оксидной плёнкой. Вхлороводородной и разбавленной серной кислотах растворяется, при этом если кислота полностью освобождена от растворённого кислорода, получается (*) Раскалённый хром реагирует с парами воды: 2Сr + ЗН2О = Сг2О3 + ЗН2 * соли хрома (II), а если реакция протекает на воздухе - соли хрома (III). Сг + 2HCI = СгСl2 + Н2 4Cr + 12HCI + О2 = 4СrCl3 + 4Н2 + 2Н2О Оксиды и гидроксиды хрома: Хром образует следующие оксиды и гидроксиды: СrO Сг(ОН)2 Сг2O3 Сг(ОН)3 CrO3 Н2СrO4 Оксид хрома (II) СгО и соответствующий ему Сг(ОН)2, проявляют основные свойства: СrO + 2HCI = CrCl2 + Н2O Оксид хрома (II) превращается в оксид хрома (III). Сr(ОН)2 получают в виде жёлтого осадка при действии раствора щёлочи на СrCl2; Сг2+ + 2ОН- = Сг(ОН)2; Сг(ОН)2 – восстановитель При прокаливании превращается в Сг2О3 Соединения хрома (II) легко окисляются кислородом воздуха в соединения хрома (III). 2Сг(ОН)2 + 1/2О2 + Н2О = 2Сг(ОН)3 оксид хрома (III) Сг2О3 и гидроксид хрома (III) Сг(ОН)з - амфотерные соединения. Сг2О3 - тугоплавкий порошок зеленого цвета. По твёрдости близок к корунду. Получается соединением элементов при высокой температуре. 3 лаборатории получают нагреванием дихромата аммония: t° (NН4)2Сг2O7 = Сг2О3 + N2 + 4Н2O При растворении оксида и гидроксида (III) в растворах щелечей образуются комплексные соединения хрома: Сг2О3 + 6NaOH + ЗН2О = 2Na3[(Cr(OH)6] при сплавлении – метахромиты t° Сг2О3 + 2КОН = 2КСrO2 + Н2О и ортохромиты t° Cr(OH)3 + 3NaOH = Na3CrO3 + ЗН2О С кислотами Cr2O3 и Cr(OH)3 дают соли хрома (III): Cr2O3 + 6HCl = 2CrCl3 + 3Н2О 2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6Н2О при прокаливании Cr(OH)3 образуется Сг2О3: to 2Cr(OH)3 = Cr2o3 + 3Н2О Оксид хрома (VI) СгО3 - кислотный оксид. Получение: К2Сг2О7 + H2SO4 = 2CrO3 + K2SO4 + Н2О конц; Сильный окислитель: окисляет йод, серу, фосфор, уголь, превращаясь в Сг2О3 3S + 4СгО3 = 3SO2 + 2Cr2O3 при нагревании до 250°С разлагается: 4СгО3 = 2Сг2О3 + ЗО2 СгО3 легко растворяется в воде, образуя хромовые кислоты. С избытком воды образует хромовую кислоту Н2CrO4 (соли - хроматы). СгОз + Н2О = Н2СгО4 При большой концентрации СгО3 образуется дихромовая кислота Н2Сг2О? (соли - дихроматы). 2СгО3 + Н2О = Н2Сr2О7 Дихромовая кислота при разбавлении переходит в хромовую кислоту: Н2Сr2О7 + Н2О - 2Н2СrО4 Хромовые кислоты существуют только в водном растворе. С возрастанием степени окисления основные свойства гидроксидов ослабевают, а кислотные усиливаются. Сr(ОН)2 - основной гидроксид Сr(ОН)3 - амфотерный гидроксид - кислотные свойствА Хроматы и дихроматы Хроматы образуются при взаимодействии СгО3, или растворов хромовых кислот со щелочами: СгОз + 2NaOH = Na2CrO4 + Н2О Дихроматы получаются при действии на хроматы кислот: 2 Na2Cr2O4 + H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О Возможен и обратный переход при добавлении щелочей к растворам дихроматов Na2Cr2O7 + 2NaOH = 2Na2CrO4 + Н2О Равновесие в системе хромат дихромат можно представить следующими уравнениеми: 2СгО42- + 2Н+ = Сг2О72- + Н2О; Сг2О72- + 2ОН- = 2 CrO 42- + Н2О В кислых растворах существуют преимущественно дихроматы (растворы оранжевого цвета), а в щелочных - хроматы (растворы желтого цвета). Для соединений хрома характерны окислительно - восстановительные реакции. Соединения хрома (II) - сильные восстановители, они легкоокисляются 4(5гС12 + О2 + 4HCI = 4СгС1з + 2Н2О Для соединений хрома (!!!) характерны восстановительные свойства. Под действием окислителей они переходят: в хроматы - в щелочной среде, в дихроматы - в кислой среде. 2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8Н2О; 5Cr2(SO4)3 + 6KMnO4 + 11H2O = 3K2Cr2O7 + 2H2Cr2O7 + 6MnSO4 + 9H2SO4 Соли хромовых кислот в кислой среде - сильные окислители: 3Na2SO3 + К2Сг2О7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O Применение: Хром является компонентом нержавеющих сталей. Стали, содержащие хром, являются жаропрочными и обладают высокой стойкостью к коррозии. К2Сг2О7 (хромпик), Na2Cr2O7 и (NH4)2Cr2O7 применяют для дубления кожи, в производстве спичек, красок, взрывчатых веществ.
45). Марганец (лат. Manganum), Mn, химический элемент VII группы периодической системы Менделеева; атомный номер 25, атомная масса 54,9380; тяжелый серебристо-белый металл. В природе элемент представлен одним стабильным изотопом 35Мn. Распространение Марганца в природе. Среднее содержание Марганец в земной коре 0,1%, в большинстве изверженных пород 0,06-0,2% по массе, где он находится в рассеянном состоянии в форме Мn2+ (аналог Fe2+). На земной поверхности Мn2+ легко окисляется, здесь известны также минералы Мn3+ и Мn4+. Физические свойства Марганца. Плотность Марганца 7,2-7,4 г/см3; tпл1245 °С; tкип 2150 °С. Марганец имеет 4 полиморфные модификации: α-Мn (кубическая объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn (кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объемноцентрированная). Температура превращений: α=β 705 °С; β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов. Химические свойства Химически Марганец достаточно активен, при нагревании энергично взаимодействует с неметаллами - кислородом (образуется смесь оксидов Марганца разной валентности), азотом, серой, углеродом, фосфором и другими. При комнатной температуре Марганец на воздухе не изменяется: очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного Марганца. При нагревании в вакууме Марганец легко испаряется даже из сплавов. В соединениях Марганец обычно проявляет валентность от 2 до 7 (наиболее устойчивы степени окисления +2, +4 и +7). С увеличением степени окисления возрастают окислительные и кислотные свойства соединений Марганца. Соединения Mn(+2)- восстановители. Оксид MnO - порошок серо-зеленого цвета; обладает основными свойствами. нерастворим в воде и щелочах, хорошо растворим в кислотах. Гидрооксид Mn(OH)3 - белое вещество, нерастворимое в воде. Соединения Mn(+4) могут выступать и как окислители (а) и как восстановители (б): MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (а) (по этой редакции в лабораториях получают хлор) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (б) (реакция идет при сплавлении). Хлорид марганца(II) - в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом: MnCO3 + 2HCl = MnCl2 + CO2 + H2O Сульфат марганца (II) - в безводном состоянии практически не имеющий цвета порошок, горький на вкус и получающийся при дегидратации соответствующих кристаллогидратов (MnSO4·nH2O, где n = 1,4,5,7). Гептагидрат сульфата марганца иногда встречается в природе в виде минерала миллардита и устойчив при температуре ниже 9° C. При комнатной температуре устойчив MnSO4·5H2O, называемый марганцевым купоросом. В промышленности сульфат марганца получают растворением пиролюзита в горячей концентрированной серной кислоте: 2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O. Cоли двухвалентного марганца каталитически действуют на протекание некоторых окислительных процессов, особенно происходящих под действием атмосферного кислорода, на этом основано их применение в качестве сиккативов - веществ, которые будучи растворенными в льняном масле, ускоряют его окисление кислородом воздуха и, тем самым, способствуют более быстрому высыханию. Льняное масло, содержащее сиккатив, называют олифой. В качестве сиккативов применяются некоторые органические соли марганца. Из соединений марганца(IV) наибольшее значение имеет диоксид марганца, который является важнейшим минералом марганца. Различают несколько форм природного диоксида маргаца: пиролюзит, рамсделит, псиломелан и криптомелан. Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:Mn(NO3)2 = MnO2 + 2NO2 Диоксид марганца представляет собой черный порошок амфотерного характера, проявляющий как окислительные, так и восстановительные свойства. Диоксид марганца, введенный в состав стекла, уничтожает зеленую окраску, обусловленную силикатом железа и придает стеклу розовый цвет (или черный, если MnO2 добавлено много). Тонкодисперсный порошок диоксида марганца обладает адсорбирующими свойствами: поглощает хлор, соли бария, радия и некоторых других металлов. Несмотря на огромную значимость пиролюзита, в быту гораздо чаще приходится встречаться с веществом, в котором марганец семивалентен, - перманганатом калия («марганцовкой»), получившим распространение благодаря его ярко выраженным антисептическим свойствам. Сейчас перманганат калия получают электролитическим окислением растворов манганата (VI) калия. Это соединение представляет собой кристаллы пурпурно-красного цвета, устойчивые на воздухе и умеренно растворимые в воде. Однако его растворы в воде быстро разлагаются на свету и медленно в темноте с выделением кислорода. Перманганат калия - сильный окислитель. Оксид марганца(VII) Mn2O7 - марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия: 2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O Это вещество - чрезвычайно сильный окислитель, взрывается при ударе или нагревании. Многие вещества, такие как сера, фосфор, древесная стружка, спирт, при малейшем соприкосновении с ним воспламеняются. При растворении в большом количестве воды образует марганцевую кислоту.
46 Портландцемент (англ. Portland cement) — гидравлическое вяжущее вещество, получаемое путем совместного помола цементного клинкера, гипса и добавок, в составе которого преобладают силикаты кальция (70-80 %). Это вид цемента, наиболее широко применяемый во всех странах. Название получил по имени острова Портленд (Portland) в Англии, так как по цвету похож на добываемый там природный камень. Основой портландцемента являются силикаты (алит и белит). Процесс производства Портландцемент получают тонким измельчением клинкера и гипса. Клинкер — продукт равномерного обжига до спекания однородной сырьевой смеси, состоящей из известняка и глины определённого состава, обеспечивающего преобладание силикатов кальция (3СаО∙SiO2и 2СаО∙SiO2 70-80 %). Самые распространённые методы производства портландцемента так называемые «сухой» и «мокрый». Всё зависит от того, каким способом смешивается сырьевая смесь — в виде водных растворов или в виде сухих смесей. При измельчении клинкера вводят добавки: 1,5…3,5 % гипса СaSO4∙2H2O (в перерасчёте на ангидрид серной кислоты SO3) для регулирования сроков схватывания, до 15 % активных минеральных добавок — для улучшения некоторых свойств и снижения стоимости цемента. Сырьём для производства портландцемента служат смеси, состоящие из 75…78 % известняка (мела, ракушечника, известнякового туфа, мрамора) и 22…25 % глин (глинистых сланцев, суглинков), либо известняковые мергели, использование которых упрощает технологию. Для получения требуемого химического состава сырья используют корректирующие добавки: пиритные огарки, колошниковую пыль, бокситы, пески, опоки, трепелы. При мокром способе производства уменьшается расход электроэнергии на измельчение сырьевых материалов, облегчается транспортирование и перемешивание сырьевой смеси, выше гомогенность шлама и качество цемента, однако расход топлива на обжиг и сушку составляет на 30-40 % больше чем при сухом способе. Обжиг сырьевой смеси проводится при температуре 1 470°C в течение 2…4 часов в длинных вращающихся печах (3,6х127 м, 4×150 м и 4,5х170 м) с внутренними теплообменными устройствами, для упрощения синтеза необходимых минералов цементного клинкера. В обжигаемом материале происходят сложные физико-химические процессы. Вращающуюся печь мокрого способа условно можно поделить на зоны: сушки (температура материала 100…200 °C — здесь происходит частичное испарение воды); подогрева (200…650 °C — выгорают органические примеси и начинаются процессы дегидратации и разложения глинистого компонента). Например, разложение каолинита происходит по следующей формуле: Al2O3∙2SiO2∙2H2O → Al2O3∙2SiO2 + 2H2O; далее при температурах 600…1 000 °C происходит распад алюмосиликатов на оксиды и метапродукты. декарбонизации (900…1 200 °C) происходит декарбонизация известнякового компонента: СаСО3 → СаО + СО2, одновременно продолжается распад глинистых минералов на оксиды. В результате взаимодействия основных (СаО, MgO) и кислотных оксидов (Al2O3, SiO2) в этой же зоне начинаются процессы твердофазового синтеза новых соединений (СаО∙ Al2O3 — сокращённая запись СА, который при более высоких температурах реагирует с СаО и в конце жидкофазового синтеза образуется С3А), протекающих ступенчато; экзотермических реакций (1 200…1 350 °C) завершется процесс твёрдофазового спекания материалов, здесь полностью завершается процесс образования таких минералов как С3А, С4АF (F — Fe2O3) и C2S (S — SiO2) — 3 из 4 основных минералов клинкера; спекания (1 300→1 470→1 300 °C) частичное плавление материала, в расплав переходят клинкерные минералы кроме C2S, который взаимодействуя с оставшимся в расплаве СаО образует минерал АЛИТ (С3S); охлаждения (1 300…1 000 °C) температура понижается медленно. Часть жидкой фазы кристаллизуется с выделением кристаллов клинкерных минералов, а часть застывает в виде стекла. Узнать данный вид цемента можно по внешнему виду — это зеленовато-серый порошок. Как и все цементы, если к нему добавить воду, он при высыхании принимает камнеобразное состояние и не имеет существенных отличий по своему составу и физико-химическим свойствам от обычного цемента. ПДК в воздухе (согласно ГОСТ 12.1.005-88): 6 мг/м3 Существуют следующие виды портландцемента: быстротвердеющий; нормальнотвердеющий; пластифицированный; гидрофобный; сульфатостойкий; дорожный; белый и цветной; с умеренной экзотермией; с поверхностноактивными органическими добавками. При твердении цемента происходят реакции гидратации, гидролиза и обменного взаимодействия, протекающие при затворении цемента водой в жидкой фазе или па поверхности твердых частиц цемента. Большинство реакций сопровождается выделением тепла. Продукты реакции — твердые вещества либо квазитвердые, частично растворимы в воде и образуются в условиях постоянного уменьшения массы воды в процессе твердения.
Изучение химических реакций, протекающих при взаимодействии заводского цементного клинкера с водой, связано с большими трудностями. Клинкер состоит из минералов, в различной степени модифицированных твердыми растворами, застывшей жидкой фазы, стекла и т. п., и поэтому условия его твердения иные, чем у отдельных синтезированных в лабораторных условиях минералов. Кроме того, вода в процессе взаимодействия с цементом насыщается переходящими в раствор известью, гипсом и щелочами, наличие и концентрация которых в жидкой фазе твердеющего цемента существенно влияет на состав гидратных новообразований. При этом наблюдается взаимовлияние отдельных реакций, происходящих при твердении.
47 При гидратации индивидуальных синтетических минералов — силикатов кальция было установлено, что реакция C3S с водой приводит к образованию C3S2HX, на пограничной поверхности возникает пленка толщиной в несколько молекул. При комнатной температуре реакция C3S с водой стехиометрически описывается уравнением: 2(3 Ca0-Si02) +6Н20 = 3 СаО-2 SiOa-3 Н20 + ЗСа(ОН)3. При гидратации портландцемента в нормальных условиях образующиеся гидросиликаты кальция имеют переменный состав, в значительной степени близки к аморфным веществам и не образуют полной кристаллической структуры, которая возникает при твердении цемента в условиях повышенных температуры и давления. Они могут быть отнесены к полукристаллическим слабозакристаллизованным соединениям. К полукристаллическим слабозакристаллизованным относят также соединения, дающие на порошкограммах более трех линий, в которых отсутствует нормальный трехмерный порядок, характерный для кристаллических объектов. Относительно хорошо образованные кристаллические гидросиликаты могут быть обозначены (по Тейлору): С —s — Н (I), если C/S = 0,8—1,5; С — S —Н (II), если C/S>1,5; в некоторых работах гидросиликаты С — S — Н (I) обозначаются С — S — Н (В), поскольку имеют тот же состав» но отличаются меньшей степенью закристаллизованности. Образующийся в цементном камне гидроксид кальция (СН) может быть отнеСен к веществам с полной кристаллической структурой, которую можно наблюдать в оптический микроскоп. М. М. Сычев [138] рассматривает гидратацию клинкерных минералов как процесс, при котором происходит разрыв ионных связей между тетраэдрами S1O4, мостиковыми ионами кальция и кислородом, в том числе разрыв более ковалентных связей Si— О в тетраэдрах. При этом связи Са—О—Si рвутся при про- тонизации, а связи Si — О — Si в результате комплек- сообразования с ОН- ионами и повышения координационного числа Si до 5—6 при более высоком значении рН. Состав, структура и другие физико-химические характеристики гидросиликатов кальция (ГСК) изучались Н. В. Беловым, Е. Н. Беловой, В. В. Тимашевым, М. М. Сычевым, X. Ф. У. Тейлором, Г. J1. Калоусеком [8, 135, 137, 138, 140]. Исследованиями в этой области занимались также В. В. Илюхин, В. А. Кузнецов, А. Н. Ло- бачев, В. С. Бакшутов [34]. ГСК различаются по основности (СаО: Si02), содержанию воды, характеру кристаллизации и другим показателям. Некоторые гид- рос'иликаты кальция синтезированы при различных температурах при атмосферном и повышенном давлении, другие встречаются в природе. Гидросиликаты кальция относятся к волластонитовой — ксонотлитовой, тоберморитовой, гиролитовой группам; выделена также группа высокоосновных ГСК- X. Ф. У. Тейлор отмечает, что С —S — Н-фаза не подобна тобермориту, а является гелем с характерной слабой закристаллизованностью [140]. По представлениям М. М. Сычева, образование С — S — Н-фазы является результатом перестройки слоя минерала,, откуда выщелочен избыточный кальций и через который происходит диффузия ионов Са2+ и ОН~ в сторону жидкости. Это положение теперь дополнено представлениями Тейлора о возможности существования промежуточного слоя под слоем новообразований и названного слоем Тейлора. Это гслеобразиый слой с низкой основностью, чем, видимо, объясняется наличие внешних и внутренних продуктов гидратации, различающихся по основности. В гелеподобном (квазитвердом) слое Тейлора выделяют зоны реакции растворения, гидро- ксилирования и растворения на границе раздела слоя Тейлора и водной среды. Состав и морфология фазы С — S — Н, образующейся в пространстве, занятом вначале соответственно цементным зерном и водой, различны во внешних и внутренних частях зерна. Как «внутренний» продукт, так и «внешний», содержащий больше Са2+, образуются вследствие хемо- сорбции ионов Са++ наружной или внутренней поверхностью слоя Тейлора. Количество «внешнего» С —S — Н крайне мало по сравнению с содержанием «внутреннего» С — S — Н. Показано, что в первые минуты гидратации происходит конгруэнтное растворение минералов и затем осаждение из раствора С — S — Н- фазы на поверхности алита. Полагают также, что С — S — Н-фаза содержит большое количество примесных атомов; благодаря своей аморфности и чрезвычайно развитой удельной поверхности она отличается высокой диссоциативностыо. Поскольку жидкая фаза твердеющей системы (7) быстро и полно насыщается оксидом кальция, полагают, что вначале образуется гидросиликат кальция C2SH2, который по мере выделения извести в твердую фазу переходит в CSH(B) (8). Этому способствует также переход в раствор щелочей, снижающих в нем концентрацию извести. Гидратация |3-C2S в указанных выше условиях идет по приведенной выше схеме, но при меньшем выделении извести. Под электронным микроскопом внешний слой С—S—Н-фазы имеет вид рыхлой фольги или весьма тонких волокон, порядка нескольких молекулярных слоев (9, 10). Удельная поверхность их довольно высока и в зависимости от степени слипания составляет примерно 250—350 м2/г. Можно заметить в этом сходство с некоторыми глинистыми минералами. Способность к обратимой отдаче воды указывает па то, что вода находится между слоями кристаллической решетки, плотность которой в зависимости от содержания воды может меняться. Считают, что это одна из важнейших Причин, от которых зависят многие строительно-технические свойства портландцемента и, в частности, ус'адка и набухание. Гидратация Са3А с водой протекает с большой скоростью при значительном выделении тепла. Вначале при температуре до 25°С образуется С3АНИ„12 в виде гексагональных пластинок. Однако считают, что это соединение является гетерогенной эквимолекулярной смесью С4АН12 и C2AHs. Гидроалюминаты общего состава C4AHX в зависимости от температуры и влажности среды могут иметь следующее содержание воды: С4АН19—С4АН13—С4АНИ— С4АН7. По мере повышения температуры гексагональные гидроалюминаты кальция оказываются неустойчивыми и постепенно превращаются в стабильные кубические кристаллы С3АН6. При затворении С3А ледяной водой и охлаждении твердеющей системы образуется C4AHj3 и АН3. При температуре затворения 21°С реакция протекает по схеме: 3 СаО - А1203 4- 6 Н20 = 3 Са0-А1г03-6Н,0 С3АН6 является единственным устойчивым соединением из всех гидроалюминатов кальция. Другие гидроалюминаты кальция медленно при нормальной температуре и весьма быстро при повышенных температурах переходят в кубические кристаллы С3АН6 (11). Такая перекристаллизация влияет на структуру и соответственно на прочность цементного камня; при высоком содержании в нем гидроалюминатов калышя возможно значительнее снижение прочности. При гидратации С3А в присутствии некоторых соединений не исключено появление комплексных новообразований: 3 СаО-Al203-3 CaS04-31 Н20, 3 СаО - Al203-CaS04-12 Н20, 3 СаО - А1203-СаС12- (10 — 12) Н20, ЗСа0-А1203-Са (N03)o 10Н20, ЗСа0-А1203 (Са, Mg)C08-11Н20. C4AHI3 можно рассматривать также как ЗСаО • • А1203 Са (ОН) 2 12Н20. Гидратация алюмоферритов кальция исследована применительно к наиболее часто встречающемуся в клинкере C4AF; его гидратация также зависит от температуры среды и содержания в растворе извести. В условиях гидратации портландцемента, т. е. насыщенного известью раствора при нормальной температуре, взаимодействие его с водой стехиометрически описывается следующим уравнением: 4 Ca0.AI203.Fe.203 + 2 Са(ОН)2 + ЮН20 = ЗСа0-А1203-6На0 -f 3Ca0-Fe203-6H20. В результате образуются весьма устойчивые смешанные кристаллы С3(А, F)H6. При низкой температуре, примерно около 0°С, в насыщенном известью растворе образуется С4 (A, F) Hj3, гексагональные кристаллы кото рого также постепенно переходят в С3(А, F)H6. Важным свойством алюмоферритов кальция является способность образовывать при гидратации ряд твердых растворов между гидроферритами и гидроалюминатами кальция, что благоприятно влияет, в частности, на коррозиеустойчивость портландцемента. Гидратация содержащихся в клинкере свободной извести, а также периклаза (несвязанной MgO) протекает медленно с образованием гидроксида кальция и бру-' сита — Mg(ОН)2. При крупных кристаллах свободной извести или периклаза становится особо заметным увеличение объема этих гидратных новообразований, что может вызвать существенные напряжения в цементном камне, нарушающие его структуру. Допустимое содержание СаОСВоб в нормально обожженном клинкере не должно превышать 1% ив отдельных случаях при тонком измельчении цемента — 2%. Валовое содержание оксида магния в клинкере ограничено по ГОСТ —5%. При взаимодействии с водой щелочных соединений силиката и алюмината кальция (К20*23Са0- 12Si02 и Na20• 8СаО• ЗА1203) щелочи переходят в раствор. Гидратация клинкерной жидкости, застывшей при охлаждении в стекловидном состоянии, приводит к образованию твердых растворов вида С3(А, F)H6. В их составе в качестве изоморфных компонентов находятся силикатные образования типа природных минералов группы гранатов — C3FS3 и СзА53, в которых произошло замещение 6Н20 на 3Si02. Образующиеся при этом гидратные соединения называются гидрогранатами (12) и имеют состав ЗСаО(А1, Fe)203-Si02(6— —2х)Н?0, причем при нормальной температуре «*»' может быть равен 0,5—0,7. Сульфат кальция (гипс), вводимый в портландцемент при его помоле для регулирования сроков схватывания, при затворснии портландцемента водой переходит в раствор и в процессе гидратации образует (13) гидросульфоалюминат кальция ЗСаО- Al203-3CaS04- • 31Н20. Известен также моносульфогидроалюминат кальция 3Ca0-A]203-CaS04']2H20. Первое соединение по структуре кристаллов и оптической характеристике соответствует природному минералу эттрингиту. Высокосульфатная его форма имеет игольчатую структуру кристаллов, часто в виде сферолитов, — низкосульфатная характеризуется гексагональными пластинками, которые также могут иметь вид сферолитов [75]. В насыщенном растворе гипса и извести вначале образуется высокосульфатная форма гидросульфоалюмина- та кальция; после израсходования всего гипса по мнению ряда ученых начинает появляться низкосульфатная форма. Ее считают также твердым раствором гипса с ЗСа0-А120з-Са(0Н)2-12Н20(С4А111з). Однако эта точка зрения встречает возражения. Гидросульфоалюминат кальция устойчив при определенной концентрации извести глинозема и серного ангидрида. Несмотря на существование природного эттрингита, что свидетельствует об устойчивости, многие экспериментальные данные указывают на возможность его поверхностного разложения под действием углекислоты; его метастабильносгь проявляется при повышении температуры примерно до 363 к. В цементном камне образуется также гидросульфофер- рит кальция — 3Ca0-Fe203*3CaS04-31H20, а также его твердый раствор состава ЗСаО-(Al, Fe)203-3CaS04- •31Н20. При гидратации цемента эти соединения возникают очень быстро, причем играют большую роль в процессах формирования цементного камня. В. В, Ти- машев отмечает, что скорость реакции гидратации цемента зависит от скорости диффузии молекул воды и растворенных ионов через слой продуктов реакции, располагающихся в виде оболочки на негидратированной поверхности частиц. Для определения скорости гидратации пользуются различными уравнениями,
 2015-06-05
2015-06-05 1447
1447
