Реакционная способность органических соединений
Специфические реакции дикарбоновых кислот
1.Реакция декарбоксилирования при нагревании щавелевой и малоновой кислот
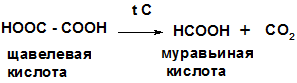 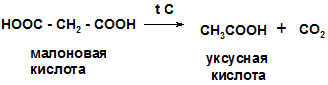 |
 2. При нагревании янтарной глутаровой и малеиновой кислот образуется циклический ангидрид
2. При нагревании янтарной глутаровой и малеиновой кислот образуется циклический ангидрид
Кислотно-основные свойства органических соединений рассматриваются на основе протолитической теории кислот и оснований Брёнстеда –Лоури и проявляются в кислотно-основном взаимодействии. Кислоты Брёнстеда – доноры протона R–ХH всегда содержат кислотный центр –XH (ОН, -NH, -SH, -CH). Различают ОН – кислоты (карбоновые кислоты, спирты, фенолы), NH- кислоты (амины, амиды), SH-кислоты (тиолы). Основания Брёнстеда - акцепторы протона. Основания делятся на n-основания, если основным центром является гетероатом (атом неметалла), который содержит неподеленную электронную пару (кислород, азот, сера), и p-основания, если основным центром является p- связь между углеродами. Основные центры: N, O, S, p-связь.
Большинство органических соединений могут проявлять свойства как кислот, так и оснований (быть и донорами и акцепторами протона). Какую роль данное соединение будет выполнять, зависит от второго реагента, так как кислота проявляет свои свойства только в присутствии сильного основания и наоборот. Согласно законам термодинамики каждая частица самопроизвольно стремится перейти в более устойчивое состояние и уменьшить тем самым энтальпию системы. Так, сильная кислота является неустойчивой и легко отдает протон основанию. Сильное основание легко присоединяет протон отрывая его от кислоты. Данные процессы идут самопроизвольно, так как сопровождаются уменьшением свободной энергии (DG<0). Поэтому в реакциях важно определить сравнительную силу кислот или оснований, так как это определяет самопроизвольное протекание кислотно-основного взаимодействия.
|
|
|
Сила кислоты определяется стабильностью сопряженного с ней основания (аниона). Чем стабильнее анион, тем сильнее кислота, а стабильность аниона зависит от степени делокализации электронной плотности (энтропийный фактор). Поэтому усиливают кислотность:
1) сопряжение с кислотным центром
2) большой радиус атома в кислотном центре
3) высокая электроотрицательность атома в кислотном центре
4) электроноакцепторные заместители в молекуле кислоты
Сравнительная сила кислот: карбоновые кислоты> фенолы > тиолы многоатомные спирты> одноатомные спирты > амины
1.Наиболее сильные кислоты (карбоновые кислоты, фенолы, тиолы) взаимодействуют со щелочами с образованием соли.
2. Средние по силе кислоты многоатомные спирты взаимодействуют с гидорксидом меди (II), с образованием хелатного комплекса.
|
|
|
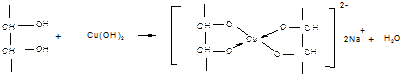
3. Слабые кислоты одноатомные спирты взаимодействуют только со щелочными металлами.
Сила оснований определяется степенью локализации электронной плотности на основном центре, следовательно, все факторы, усиливающие кислотность будут в той же мере снижать силу оснований.
Сравнительная сила основных центров:
N> O>S>p -связь
Сопряжение с основным центром максимально ослабляет основность. Электронодоноры усиливают основность.
Примеры:
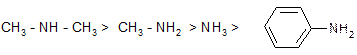
Доказательство основных свойств аминов
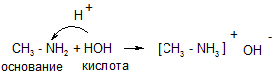 |
 2014-02-02
2014-02-02 7716
7716







