PH-метрия, водородный показатель, понятие рН
Вода является слабым электролитом; она слабо диссоциирует по уравнению
H2O = H+ + OH-
При 25 °С в 1 л воды распадается на ионы 10-7 моль H2O. Концентрация ионов H+ и OH- (в моль/л) будет равна
[H+]=[OH-]=10-7
Чистая вода имеет нейтральную реакцию. При добавлении в нее кислоты концентрация ионов H+ увеличивается, т.е. [H+]>10-7 моль/л; концентрация ионов OH- уменьшается, т.е. [OH-]<10-7 моль/л. При добавлении щелочи концентрация ионов OH- увеличивается, т.е. [OH-]>10-7 моль/л; следовательно, [H+]<10-7 моль/л. На практике, для выражения кислотности или щелочности раствора вместо концентрации [H+] используют ее отрицательный десятичный логарифм, который называют водородным показателем pH:
pH=-lg[H+]
В нейтральной воде pH=7. Для растворов с кислой реакцией pH<7. Для растворов со щелочной реакцией pH>7.
Если учесть, что свойства растворов зависят от активностей находящихся в них ионов, то следует приведенное выражение записать в виде:
pH = lg aH+
В разбавленных растворах значения концентрации и активности совпадают и только при высокой минерализации могут быть значительные расхождения.
В настоящее время pH считается характеристикой активности ионов водорода. Поэтому, иногда в символ pH вводят нижний индекс "a": pHa или paH. Обычно, это делается, когда необходимо явно подчеркнуть отличие определения водородного показателя через концентрацию или активность.
Буферные растворы
Многие аналитические реакции проводят при строго определенном значении pH, которое должно сохраниться в течение всего времени проведения реакции. В ходе некоторых реакций pH может изменяться в результате связывания или высвобождения ионов H+. Для сохранения постоянного значения pH применяют буферные растворы.
Буферные растворы представляют собой чаще всего смеси слабых кислот с солями этих кислот или смеси слабых оснований с солями этих же оснований. Если, например, в ацетатный буферный раствор, состоящий из уксусной кислоты CH3COOH и ацетата натрия CH3COONa добавить некоторое количество такой сильной кислоты, как HCl, она будет реагировать с ацетат-ионами с образованием малодиссоциирующей CH3COOH:
CH3COO- + H+ = CH3COOH
Таким образом, добавленные в раствор ионы H+ не останутся свободными, а будут связаны ионами CH3COO-, и поэтому pH раствора почти не изменится.
При добавлении раствора щелочи к ацетатному буферному раствору ионы OH- будут связаны недиссоциированными молекулами уксусной кислоты CO3COOH:
OH- + CH3COOH = H2O + CH3COO-; Следовательно, pH раствора и в этом случае также почти не изменится. Буферные растворы сохраняют свое буферное действие до определенного предела, т. е. они обладают определенной буферной емкостью. Если ионов H+ или OH- оказалось в растворе больше, чем позволяет буферная емкость раствора, то pH будет изменяться в значительной степени, как и в небуферном растворе.
Обычно в методиках анализа указывается, каким именно буферным раствором следует пользоваться при выполнении данного анализа и как его следует приготовить.
Для настройки pH-метров применяют стандартные буферные растворы с точными значениями pH. Принятая в России по стандарту 8.134-74 шкала pH основана на воспроизводимых значениях pH нескольких растворов. Шкала pH обладает внутренней согласованностью, т.е. экспериментально измеренная величина pH не зависит от того, какой из растворов был выбран в качестве стандартного.
Способы измерения pH Для определения величины pH существуют два основных метода: колориметрический и потенциометрический. Колориметрический метод основан на изменении окраски индикатора, добавленного к исследуемому раствору, в зависимости от величины pH. Этот метод недостаточно точен, требует введения солевых и температурных поправок, дает значительную погрешность при очень малой минерализации исследуемой воды (менее 30 мг/л) и при определении pH окрашенных и мутных вод. Метод нельзя применять для вод, содержащих сильные окислители или восстановители. Используется обычно в экспедиционных условиях и для ориентировочных определений. Потенциометрический метод намного точнее, лишен в значительной мере всех перечисленных недостатков, но требует оборудования лабораторий специальными приборами - pH-метрами. Потенциометрический метод основан на измерении ЭДС электродной системы, состоящей из индикаторного электрода и электрода сравнения. Электрод сравнения иногда называют вспомогательным электродом. Наибольшее практическое применение нашел стеклянный индикаторный электрод, который можно использовать в широком диапазоне pH и в присутствии окислителей. Кроме стеклянного электрода, для определения величины pH применяются также водородный, хингидронный, сурьмяный и другие электроды. Однако широкого распространения они не получили.
Стеклянный электрод Стеклянный электрод изготовляется из специальный сортов стекла, о бладающих некоторой электропроводностью, достаточной, чтобы тонкую пленку из такого стекла можно было бы включить в качестве составляющей электрической цепи. Для измерения pH используется стекло, электропроводность которого обусловлена перемещением в стекле ионов H+ (электропроводность любого стекла обусловлена способностью к перемещению катионов относительно неподвижного остова - полианиона полимерной кремниевой кислоты). Собственно стеклянный электрод представляет собой стеклянную трубку с выдутым на ее конце шариком с очень тонкой стенкой, в которую залита суспензия AgCl в растворе HCl и погружена серебряная проволока. Таким образом, внутри трубки с шариком находится хлорсеребряный электрод. Для измерения pH стеклянный электрод погружают в испытуемый раствор (тем самым не внося в него никаких посторонних веществ). В этот же раствор напрямую или через электролитический ключ погружают электрод сравнения. Таким образом, образуется гальванический элемент, состоящий из хлорсеребрянного электрода и электрода сравнения, но внутренняя электролитическая цепь этого элемента включает электропроводную стеклянную пленку, а также исследуемый раствор. В полученной системе перенос электронов от хлорсеребрянного электрода к электроду сравнения, происходящий под действием непосредственно измеряемой разности потенциалов, неизбежно сопровождается переносом эквивалентного количества протонов из внутренней части стеклянного электрода в испытуемый раствор. Если считать концентрацию ионов H+ внутри стеклянного электрода постоянной, то измеряемая ЭДС является функцией только активности ионов водорода, т.е. pH исследуемого раствора.
21) Гидролизом называются химические реакции взаимодействия заряженных частиц растворенной соли с водой, где вода проявляет амфотерные свойства, в результате чего образуются малодиссоциирующие соединения. В результате гидролиза солей среда может оказаться кислой, щелочной или нейтральной.
Если рассматривать соли как продукты взаимодействия кислот с основаниями, то в зависимости от их силы различают четыре типа солей:
1) Соли, образованные сильной кислотой и сильным основанием, например NaCl. Соли данного типа не подвергаются гидролизу, так как при взаимодействии с водой не происходит образования малодиссоциированных соединений.
2) Соли образованные слабой кислотой и сильным основанием, подвергаются гидролизу по аниону, например:
Na2CO3 ↔ 2Na+ + CO32-; H2O ↔H+ + OH-; H+ + CO32- ↔ HCO3-; H+ + HCO3- ↔ 2CO3
CO32- + 2H2O↔ H2CO3 + 2OH- pH>7, среда щелочная.
Как правило, если в системе нет катионов слабого основания, гидролиз останавливается на первой ступени, т.к. образующиеся гидроксид-ионы препятствуют дальнейшему гидролизу (по принципу Ле Шателье).
3) Соли, образованные сильной кислотой и слабым основанием, подвергаются гидролизу по катиону, например:
NH4Cl  NH4+ + Cl-; H2O ↔H+ + OH-; NH4+ + OH- ↔NH4OH; NH4+ + H2O ↔NH4OH + H+ pH<7, среда кислая.
NH4+ + Cl-; H2O ↔H+ + OH-; NH4+ + OH- ↔NH4OH; NH4+ + H2O ↔NH4OH + H+ pH<7, среда кислая.
4) Соли, образованные слабой кислотой и слабым основанием, подвергаются гидролизу и по катиону, и по аниону, например:
(NH4)2S ↔ 2NH4+ + S2-; H2O ↔H+ + OH-; NH4+ + OH- ↔NH4OH; S2- + H+ ↔HS-; HS- + H+ ↔H2S; (NH4)2S + 2H2O ↔2NH4OH + H2S pH=7, среда нейтральная.
Количественно гидролиз характеризуется двумя величинами: степенью гидролиза и константой гидролиза.
Степень гидролиза показывает, какая часть от общего количества растворенной в воде соли подверглась гидролизу. Степень гидролиза очень часто выражают в процентах: 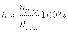 Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза – величина, равная произведению констант всех стадий, из которых складывается процесс гидролиза с учетом стехиометрических коэффициентов. Например:
NH4Cl ↔ NH4+ + Cl-; H2O↔H+ + OH-; K1= Kw= 10-14; NH4+ + OH- ↔NH4OH; K2=1/K(NH4OH)=1/1,7·10-5; NH4+ + H2O ↔NH4OH + H+; Kобщ = K1·K2=5,7·10-10.
Чем выше величина константы, тем сильнее соль подвергается гидролизу.
Константа гидролиза Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль: MA + H2O ↔ HA + MOH Применив закон действующих масс, запишем константу, соответствующую этому равновесию: K = [HA]·[MOH]/[MA]·[H2O] Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу K·[H2O]= Kг, тогда для константы гидролиза соли Kг будет иметь такой вид: Kг = [HA]·[MOH]/[MA] По величине константы гидролиза можно судить о полноте гидролиза: чем больше ее значение, тем в большей мере протекает гидролиз .Константа и степень гидролиза связаны соотношением:
Kг = С·h2/(1- h), моль/л Где С – концентрация соли в растворе, h- степень гидролизаЭто выражение можно упростить, т.к. обычно h˂˂1, тогда Kг = С·h2
Зная, константу гидролиза, можно определить pH среды: Kг = [HA]·[MOH]/[MA]
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда Kг = [OH—]2/[MA] Используя это выражение можно вычислить pH раствора [OH—] = (Kг·[MA])1/2 моль/л; [H+] = 10-14/[OH—] моль/л; pH = -lg[H+]
=================================================================================
22) можно дать следующее определение комплексных соединений: комплексными соединениями называют соединения, в узлах кристаллов которых находятся комплексы, способные к самостоятельному существованию в растворе. Существует еще и такое определение комплексных соединений - это сложные вещества, в которых можно выделить центральный атом и связанные с ним молекулы и ионы – лиганды. Состав комплексных соединений Комплексные соединения состоят из внутренней сферы – комплексного иона и внешней сферы – простых катионов или анионов. Центральный атом и лиганды образуют комплекс (внутреннюю сферу), который при записи формулы комплексного соединения заключают в квадратные скобки. Комплексообразователь является центральной частью комплекса. Как правило, комплексообразователь – это положительно заряженный ион металла, иногда комплексообразователем могут быть нейтральные атомы металла или положительно заряженные ионы металлов. В принципе комплексообразователем может выступать любой элемент, но чаще всего это d - металлы. Молекулы и ионы, окружающие комплекс, образуют внешнюю сферу. Лигандами могут быть как нейтральные молекулы (NH3, CO), так и отрицательно заряженные ионы – анионы (OH-, CN-). Лиганды связаны с центральным атомом донорно-акцепторной связью. В комплексном соединении он выступает акцептором, ибо у него на внешней оболочке имеются свободные орбитали, а лиганды – донорами, так как обладают одной или несколькими неподеленными электронными парами. Связь между внешней и внутренней сферами – ионная, поэтому в водных растворах комплексные соединения диссоциируют с образованием ионов. Число связей, образуемых комплексообразователем с лигандами, называется координационным числом. Другими словами, это число лигандов во внутренней сфере.
Координационное число, проявляемое тем или иным комплексообразователем, зависит как от заряда (степени окисления), размеров комплексообразователя, природы лигандов, так и от условий образования комплексов: концентрации исходных веществ, температуры и так далее.
В молекулах комплексных соединений встречаются практически все виды химической связи. Между комплексным ионом и внешней средой - ионная, поэтому в водных растворах комплексные соединения диссоциируют с образованием ионов.
Лиганды связаны с центральным атомом с помощью донорно – акцепторной связи. В молекулах лигандах и в ионе внешней сферы имеет место ковалентная связь. Классификация комплексов Комплексные соединения как по строению, так и по свойствам очень разнообразны. Пока нет единого признака, по которому можно было бы дать полную их классификацию. Сейчас существует несколько видов классификации комплексных соединений.
По характеру электрического заряда различают катионные, анионные, нейтральные комплексы, а также смешанные: 1. катионный комплекс можно рассматривать как образованный в результате координации вокруг положительного иона нейтральных молекул (NH3, CO). Примером таких комплексов может служить трихлорид гексааквоалюминия (III) [Al(OH2)6]Cl3. 2. анионный комплекс – комплекс, в котором в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются атомы с отрицательной степенью окисления. Например: гексофторплатинат (IV) натрия Na2[PtF6]. 3. нейтральные комплексы образуются при координации вокруг атома молекул, а также при одновременной координации вокруг положительного иона – комплексообразователя отрицательных ионов и молекул. Электронейтральные комплексы не имеют внешней сферы, например: [Co(NH3)4(NO2)Cl]. 4. смешанные комплексные соединения – те, которые содержат одновременно и комплексный анион, и комплексный катион: [Co(NH3)6][PtF6].
По типу лиганд комплексы делятся на: аквакомплексы (лиганды являются молекулами воды): [Co(H2O)6]SO4. аммиакаты (лиганды – молекулы аммиака): [Ni(NH3)6]Cl2. гидроксокомплексы (лиганды – ионы OH-): Na2[Zn(OH)4] ацидокомплексы (лиганды – анионы различных кислот): Na3[AlF6]. комплексы смешанного типа (лиганды – различные ионы или молекулы): [Co(H2O)(NH3)4Cl]Cl2. Кроме того, комплексы могут быть разделены на одноядерные комплексы – комплексы, содержащие один центральный атом – комплексообразователь, и многоядерные комплексы (содержащие два и более центральных атома. Комплексные соединения со сложной структурой комплексных молекул выделяют в отдельную группу под названием "циклических или хелатных", они содержат полидентантные лиганды, связанные с комплексообразователем несколькими связями.
Номенклатура комплексных соединений Как и в простых соединениях. В комплексах сохраняется тот же порядок названия соединений: первым называют анион, а вторым – катион независимо от того, является ли ион простым или комплексным. В названиях комплексных ионов сначала указываются лиганды в алфавитном порядке, причем независимо то заряда. В названиях комплексных катионов используются русские названия металлов (Cu(NH3)4)Cl2 - хлорид тетрааминмеди (II)). Названия анионных лигандов состоят из названия иона или корня названия с добавлением окончания "о": -бромо-, -оксо-, -родано- и т.д. Нейтральные лиганды называют также, как они бычно называются: -аква-, --нитрозил- и т.д. Число лигандов каждого вида, если их несколько, указывают греческими числительными в виде приставки: ди-, три-, тетра-, и т.п.Если анион комплексный, то в названии к комплексообразователю прибавляют суффикс "ат": гексохлоротитанат(IV) [TiCl6]2-
Степень окисления металла указывают в скобках римскими цифрами. Изомерия комплексных соединений комплексный ион донорный лиганда Изомерией называют явления существования соединений с одинаковым количественным и качественным составом, но различных по строению или расположению атомов в пространстве и в связи с этим обладающих различными свойствами. Что касается комплексных соединений, то для них существует несколько видов изомерии. Их можно объединить в две группы: виды структурной изомерии виды пространственной изомерии.
Группа видов структурной изомерии: координационная изомерия присуща таким комплексным соединениям, у которых комплексными являются и катион, и анион (т.е., у которых два комплексообразователя). При такой изомерии происходит обмен лигандами у комплексообразователя. сольватная (гидратная) изомерия характерна для соединений, имеющих одинаковый состав, но различное расположение молекул воды во внутренней и внешней сфере. Ионизационная изомерия обусловлена различным распределением ионов между внешней и внутренней сферами комплексного соединения.
Группа видов пространственной изомерии: геометрическая (пространственная) изомерия связана с различным расположением лигандов вокруг центрального атома. Иногда этот вид называют цис- и транс- изомерией. У цис- изомера одинаковые лиганды расположены по одну сторону от центрального атома, а у транс- изомера – по разные стороны от комплексообразователя. оптическая (зеркальная) изомерия встречается у комплексов, содержащих три различных лиганда. Причем расположение лигандов другой молекулы является зеркальным отражением первой молекулы. Оптические изомеры отличаются тем, что один из них вращает плоскость поляризации света вправо, а другой – влево. Лево- и правовращающие изомеры имеют разную химическую и биологическую активность. Диссоциация комплексов При растворении комплексов происходит их распад на ионы – комплексный ион и ионы внешней сферы: [Cu(NH3)4]Cl2 = [Cu(NH3)4]2+ + 2Cl- Этот процесс назван первичной диссоциацией. Первичная диссоциация протекает по типу сильных электролитов.Комплексные ионы, хотя и в незначительной степени, но тоже способны диссоциировать: [Cu(NH3)4]2+ = Cu2+ + 4NH3 Процесс частичного распада в растворе комплексного иона на составляющие назовем вторичной диссоциацией. Вторичная диссоциация проходит по типу слабых электролитов. Так как процесс вторичной диссоциации происходит в незначительной степени и обратим, то с количественной стороны он может быть охарактеризован константой равновесия, которую для комплексов назвали константой нестойкости: Константа нестойкости может служить мерой устойчивости комплекса. Чем меньше константа нестойкости, тем устойчивее комплекс.Как и в случае слабых электролитов диссоциация комплексов протекает ступенчато и каждая ступень диссоциации характеризуется своей константой нестойкости. Анализ констант нестойкости комплексов показывает, что прочность комплекса зависит: от природы центрального атома; степени его окисления; размеров и структуры электронных оболочек комплексообразователя и лигандов; природы лигандов. Чем выше заряд комплексообразователя, тем более прочный комплекс. Прочность комплекса зависит от соотношения между размерами комплексообразователя и лигандов. Более прочные комплексы получаются, когда:
небольшие размеры комплексообразователя и небольшие лиганды;
комплексообразователи с большими радиусами и крупные лиганды.
Наиболее прочные комплексы образуют переходные металлы, которые для связи с лигандами используют кроме s- p- орбиталей еще и d - орбитали нижележащих уровней.
Химические свойства комплексных соединений идентичны свойствам обычных соединений. Комплексы могут вступать в реакции обмена, замещения, окисления – восстановления и т.д. При этом комплексы могут разрушаться с образованием обычных соединений или образовывать новые более устойчивые комплексные соединения.
Комплексные соединения могут вступать в различные реакции:
обмена ионов внешней сферы: (NH3)2[Hg(SCN)4] + Co(NO3)2 = Co[Hg(SCN)4]↓ + 2NH4NO3
обмена комплексообразователя: [Zn((NH3)4]SO4 + SO4 CuSO4 = [Cu(NH3)4] SO4 + ZnSO4
образование нового более прочного комплекса: Na[Co(CH3COO)6] + 4KCNS = Na2[Co(CNS)4] + 2CH3COONa + 2CH3COOK
восстановление комплексообразователя до свободного металла: 2Ag(NH3)2OH + Zn = [Zn(NH3)4](OH)2 + 2Ag
осаждение комплексообразователя: Na4[Fe(CH3COO)6] + Na2S = FeS↓ + 6 CH3COONa
окислительно-восстановительные процессы: 2KI + 2K3[Fe(CN)6] = I2 + 2K4[Fe+2(CN)6]
-----------------------------------------------------------------------------------------------------------------------------------
23) Для объяснения химической связи в комплексах используют три метода:
метод валентных связей - строится на позиции ковалентности химической связи между комплексообразователем и лигандами, так как донорно – акцепторная связь является частным случаем ковалентной связи. Этот метод объясняет взаимодействие между комплексообразователем и лигандами как донорно – акцепторное взаимодействие, при котором центральный атом имеет на внешнем квантовым уровне ряд свободных орбиталей и выступает акцептором, а каждый лиганд содержит одну неподеленную пару электронов и является донором. При взаимодействии лигандов с комплексообразователем последний подвергается гибридизации. При этом тип гибридизации определяет геометрическую конфигурацию комплекса. Следовательно, этот метод хорошо объясняет геометрическое строение комплексных ионов. В гибридизации центрального атома могут участвовать электроны разных подуровней. В зависимости от формы орбиталей и их количества образуется тот или иной тип гибридизации и соответственно геометрическая конфигурация комплексного соединения. Например, при sp3d2 гибридизации комплекс имеет октаэдрическую конфигурацию. А при sp3-гибридизации – тетраэдрическая структура. Таким образом, метод валентных связей является наглядным методом, хорошо объясняющим геометрическую гибридизацию, но он не может дать качественной характеристики оптических свойств и прочности комплексов. В этом отношении более эффективными являются теория кристаллического поля и метод молекулярных орбиталей.
Теория кристаллического поля предпологает, что связь между лигандами и центральным атомом обеспечивается электростатическим взаимодействием между _игандами и комплексообразователем, то есть является ионной. Лиганды создают электростатическое поле, под влиянием которого изменяется электронная структура центрального атома, а именно орбитали комплексообразователя под действием поля лигандов получают различное энергетическое расположение. Если без лигандов все пять орбиталей центрального атома находятся на одном и том же энергетическом уровне, как говорят пятикратно вырождено, то в поле лигандов они расщепляются на два и более энергетических уровня, их количество зависит от симметрии поля. Метод молекулярных орбиталей как бы объединяет воедино основные положения метода валентных связей и метода валентных связей и метода кристаллического поля, основывающегося на ионном характере связи. Согласно теоретическим предпосылкам метода молекулярных орбиталей химическая связь в комплексахобеспечивается электронами, находящимися на вновь образованных молекулярных орбиталях. При взаимодействии лигандов с комплексообразователем атомные орбитали лигандов и комплексообразователя объединяются и образуют молекулярные орбитали. Для характеристики конкретного соединения пот методу молекулярных орбиталей строят энергетическую диаграмму комплекса, причем в диаграмму уровней энергии помещают только валентные орбитали комплексообразователя по одной орбитали с двумя электронами от каждого лиганда. Таким образом, все три теории, описывающие химическую связь в комплексах, дополняют друг друга и практически объясняют многие особенности комплексных соединений.
-----------------------------------------------------------------------------------------------------------------------------------
24) Окислительно-восстановительные реакции — это такие реакции, которые протекают с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Окисление ― это процесс отдачи электрона. Этот процесс сопровождается повышением степени окисления элемента. Вещество, отдающее электрон, называется восстановителем.
Восстановление ― это процесс присоединения электронов. Этот процесс сопровождается понижением степени окисления элемента. Вещество, принимающее электрон, является окислителем. Состояние атома в молекуле характеризуется с помощью понятия «степени окисления». Под степенью окисления понимают заряд атома элемента в соединении, вычисленный из предположения о том, что молекула состоит только из ионов
Классификация окислительно–восстановительных реакций Окислительно-восстановительные реакции обычно разделяют на три типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования (самоокисления-самовосстановления). Межмолекулярные реакции протекают с изменением степени окисления атомов, которые находятся в различных молекулах. Например:
2 Al + Fe2O3 →T→Al2O3 + 2 Fe, C + 4 HNO3(конц) = CO2 ↑+ 4 NO2↑+ 2 H2O.
К внутримолекулярным реакциям относятся такие реакции, в которых окислитель и восстановитель входят в состав одной и той же молекулы, например:
(NH4)2Cr2O7 →T→N2↑ + Cr2O3 + 4 H2O, 2 KNO3 →T→2 KNO2 + O2↑.
В реакциях диспропорционирования (самоокисления-самовосстановления) атом (ион) одного и того же элемента является и окислителем, и восстановителем:
Cl2 + 2 KOH →ХОЛОД→KCl + KClO + H2O, 2 NO2 + 2 NaOH = NaNO2 + NaNO3 + H2O.
Для составления уравнений окислительно-восстановительных реакций обычно используют два метода: 1 ) метод электронного баланса, 2) электронно-ионный метод.
При расчете коэффициентов в окислительно-восстановительных реакциях пользуются правилом электронного баланса: суммарное число электронов, теряемых восстановителем, должно быть равно суммарному числу электронов, приобретаемых окислителем.
Метод электронного баланса основан на определении общего числа электронов, перемещавшихся от восстановителя к окислителю. Для составления уравнения окислительно-восстановительной реакции необходимо, прежде всего, знать химические формулы исходных веществ и получающихся продуктов. Исходные вещества нам известны, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. Участие воды в реакции выясняется при составлении уравнения.
При составлении уравнения окислительно-восстановительной реакции необходимо соблюдать следующую логическую последовательность операций: рассмотрим реакцию взаимодействия Sb2S5 и HNO3. 1. Устанавливаем формулы веществ, получающихся в результате реакции: Sb2S5 + HNO3 = H3SbO4+NO+H2SO4. 2. Определяем степени окисления элементов, которые изменили ее в процессе реакции Sb2S2-5 + HN5+O3 = H3SbO4+N2+O+H2S6+O4. 3.Определяем изменения, происшедшие в значениях степени окисления и устанавливаем окислитель и восстановитель. В данной реакции степень окисления атомов серы S2- повысилась с 2- до 6+; следовательно, S2- является восстановителем. А степень окисления атомов азота N5+ понизилась с 5+ до 2+; следовательно, N5+ является окислителем. На основании этого составляем схему электронного баланса реакции:
N5+ + 3e N2+ │ 40 окислитель, процесс восстановления
S2- — 40e S6+ │ 3 восстановитель, процесс окисления
Пользуясь правилом электронного баланса, определяем общее число перемещающихся электронов нахождения наименьшего кратного. В данном случае оно равно 120.
4. Находим основные коэффициенты, то есть коэффициенты при окислителе и восстановителе
3 Sb2S5 + 40 HNO3 = H3SbO4 + NO + H2SO4.
5. Согласно закону сохранения массы расставляем коэффициенты в правой части уравнения (продукты реакции) перед окисленной и восстановленной формами:
3 Sb2S5 + 40 HNO3 = H3SbO4 + 40 NO + 15 H2SO4.
6. Проверяем число атомов каждого элемента (кроме водорода и кислорода) в исходных веществах и продуктах реакции и подводим баланс по этим элементам, расставляя коэффициенты:
3 Sb2S5 + 40 HNO3 = 6 H3SbO4 + 40 NO + 15 H2SO4.
7. Проверяем число атомов водорода в левой и правой частях уравнения и определяем число участвующих в реакции молекул воды
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4.
8. Проверяем сумму атомов кислорода в левой и правой частях уравнения. Если баланс по кислороду сходится, то уравнение реакции составлено правильно.
Все вышеописанные операции производятся последовательно с одним и тем же уравнением и переписывать реакцию несколько раз не имеет смысла. Уравнение реакции окисления сульфида сурьмы азотной кислотой, с учетом схемы электронного баланса, запишется следующим образом:
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4.
| 5S2- — 40ē = 5S6+ | восстановитель (окисление) | |
| N5+ + 3ē = N2+ | окислитель (восстановление) |
25).Электродные потенциалы. Электрохимический ряд напряжений. Направленность окислительно-восстановительных реакций в растворах В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту. Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию. Например, если окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества. Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой. гальванический элемент Даниэля-Якоби Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд. Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Его значение и знак (+ или -) определяются природой раствора и находящегося в нем металла. При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно. Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления). Zn — 2e— = Zn2+ В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления): Cu2+ + 2e— = Cu Таким образом, в элементе происходит такая реакция: Zn + Cu2+ = Zn2+ + Cu; Zn + CuSO4 = ZnSO4 + Cu Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю). Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах. Проведем реакцию 2Fe3+ + 2I— = 2Fe2+ + I2 таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник. В сосуды, содержащие растворы Fe3+ и I—, поместим инертные(платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток. Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe3+: 2I— — 2e— = I2; 2Fe3+ + 2e— = 2Fe2+ Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновеснымокислительно-восстановительным потенциалом. Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как Природа вещества (окислителя и восстановителя) Концентрация окисленной и восстановленной форм. При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста: E = E° + (RT/nF)ln(Cок/Cвос), где E – окислительно-восстановительный потенциал данной пары; E°- стандартный потенциал (измеренный при Cок = Cвос); R – газовая постоянная (R = 8,314 Дж); T – абсолютная температура, К n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе; F – постоянная Фарадея (F = 96484,56 Кл/моль); Cок – концентрация (активность) окисленной формы; Cвос– концентрация (активность) восстановленной формы. Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения: E = E° + (0,059/n)lg(Cок/Cвос) При Cок > Cвос, E > E° и наоборот, если Cок < Cвос, то E < E° Кислотность раствора. Для пар, окисленная форма которых содержит кислород (например, Cr2O72-, CrO42-, MnO4—) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H+. И наоборот, окислительно-восстановительный потенциал падает с уменьшением H+. Температура. При увеличении температуры окислительно-восстановительный потенциал данной пары также растет. Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С. Такие таблицы дают возможность сделать некоторые выводы: Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например E°(F2/2F—) = +2,87 В – сильнейший окислитель E°(K+/K) = — 2,924 В – сильнейший восстановитель Данная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами. Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+ Практически протекает в прямом направлении, т.к. E° (Sn4+/Sn2+) = +0,15 В, а E° (Fe3+/Fe2+) = +0,77 В, т.е. E° (Sn4+/Sn2+) < E° (Fe3+/Fe2+). Реакция Cu + Fe2+ = Cu2+ + Fe невозможна в прямом направлении и протекает только справа налево, т.к. E° (Сu2+/Cu) = +0,34 В, а E° (Fe2+/Fe) = — 0,44 В, т.е. E° (Fe2+/Fe) < E° (Сu2+/Cu ). В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая. Пользуясь справочными данными, можно определить ЭДС реакции. ИТАК, КАК ОПРЕДЕЛИТЬ ЭДС РЕАКЦИИ? Рассмотрим несколько реакций и определим их ЭДС: Mg + Fe2+ = Mg2+ + Fe; Mg + 2H+ = Mg2+ + H2; Mg + Cu2+ = Mg2+ + Cu; E° (Mg2+/Mg) = — 2,36 В; E° (2H+/H2) = 0,00 В; E° (Cu2+/Cu) = +0,34 В; E° (Fe2+/Fe) = — 0,44 В; Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя; ЭДС = Е0ок — Е0восст; ЭДС = — 0,44 — (- 2,36) = 1,92 В; ЭДС = 0,00 — (- 2,36) = 2,36 В; ЭДС = + 0,34 — (- 2,36) = 2,70 В; Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0. КОНСТАНТА РАВНОВЕСИЯ. Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия. Например, для реакции Zn + Cu2+ = Zn2+ + Cu Применяя закон действующих масс, можно записать K = CZn2+/CCu2+ Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди. Значение константы равновесия можно вычислить, применив уравнение Нернста E = E° + (0,059/n)lg(Cок/Cвос) Подставим в уравнение значения стандартных потенциалов пар Zn/Zn2+ и Cu/Cu2+, находим E0Zn/Zn2+ = -0,76 + (0,59/2)lgCZn/Zn2 и E0Cu/Cu2+ = +0,34 + (0,59/2)lgCCu/Cu2+ В состоянии равновесия E0Zn/Zn2+ = E0Cu/Cu2+, т.е. -0,76 + (0,59/2)lgCZn2 = +0,34 + (0,59/2)lgCCu2+, откуда получаем (0,59/2)(lgCZn2 — lgCCu2+) = 0,34 – (-0,76) lgK = lg (CZn2+/CCu2+) = 2(0,34 – (-0,76))/0,059 = 37,7 K = 1037,7 Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 1037,7 раз меньше, чем концентрация ионов цинка. Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой: lgK = (E10 -E20)n/0,059, где K — константа равновесия E10 и E20 – стандартные потенциалы окислителя и восстановителя соответственно n – число электронов, отдаваемых восстановителем или принимаемых окислителем. Если E10 > E20, то lgK > 0 и K > 1. Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E10 — E20) достаточно велика, то она идет практически до конца. Напротив, если E10 < E20, то K будет очень мала. Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E10 — E20) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий. Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции. По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций. КАК СОСТАВИТЬ СХЕМУ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции: ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода. Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод). Граница раздела фаз обозначается одной чертой — | Электролитный мостик на границе двух проводников обозначается двумя чертами — || Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую. Например, составим схему гальванического элемента, в котором осуществляется следующая реакция: Fe0 + Cd2+ = Fe2+ + Cd0 В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый. Анод Fe0|Fe2+ || Cd2+|Cd0 Катод Типичные задачи с решениями вы найдете здесь.
=================================================================================
 2015-06-05
2015-06-05 2890
2890







