Методы получения альдегидов и кетонов Окисление или окислительное дегидрирование спиртов 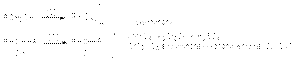 Озонолиз алкенов
Озонолиз алкенов 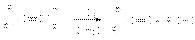 Окисление алкенов Pb(OOCCH3)4 и KIO4
Окисление алкенов Pb(OOCCH3)4 и KIO4 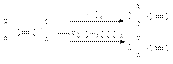 Каталитическое окисление алкенов в присутствии комплексов палладия
Каталитическое окисление алкенов в присутствии комплексов палладия 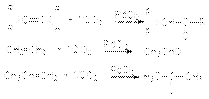 Гидратация алкинов
Гидратация алкинов 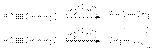 Гидроборирование алкинов
Гидроборирование алкинов 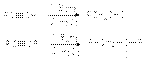 Гидроформилирование (оксосинтез) алкенов
Гидроформилирование (оксосинтез) алкенов  Условия: cat: HCo(CO)4, 150оС, 10-15 МПа.
Условия: cat: HCo(CO)4, 150оС, 10-15 МПа.
Гидролиз геминальных дигалогеналканов 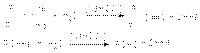 Пинаколиновая перегруппировка
Пинаколиновая перегруппировка 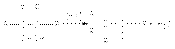 Магний-органический синтез
Магний-органический синтез 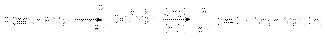 Превращение карбоновых кислот и их производных
Превращение карбоновых кислот и их производных 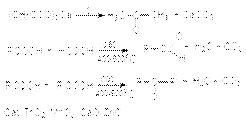 Реакция Розенмунда
Реакция Розенмунда 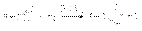
Применение альдегидов и кетонов. Формальдегид Н2С=О (его водный раствор называют формалином) используют как дубитель кожи и консервант биологических препаратов.Ацетон (СН3)2С=О – широко применяемый экстрагент и растворитель лаков и эмалей. Ароматический кетон бензофенон (С6Н5)2С=О с запахом герани, используется в парфюмерных композициях и для ароматизации мыла.Некоторые из альдегидов были сначала найдены в составе эфирных масел растений, а позже искусственно синтезированы. Алифатический альдегид СН3(СН2)7С(Н)=О (тривиальное название – пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор. Ароматический альдегид ванилин (рис. 10) содержится в плодах тропического растения ванили, сейчас чаще используется синтетический ванилин – широко известная ароматизирующая добавка в кондитерские изделия (рис. 10).  Рис. 10. ВАНИЛИН Бензальдегид С6Н5С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях. Бензофенон (С6Н5)2С=О и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара, кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов. Бензофенон обладает приятным запахом герани, и потому его используют в парфюмерных композициях и для ароматизации мыла. Способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
Рис. 10. ВАНИЛИН Бензальдегид С6Н5С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях. Бензофенон (С6Н5)2С=О и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара, кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов. Бензофенон обладает приятным запахом герани, и потому его используют в парфюмерных композициях и для ароматизации мыла. Способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
=================================================================================
69). Химические свойства карбонильных соединений. Механизм нуклеофильного присоединения к карбонильной группе. Сравнение реакционной способности. Химические свойства альдегидов и кетоновХимическое поведение альдегидов и кетонов определяется четырьмя факторами. Во-первых, положительный заряд карбонильного углерода обусловливает его восприимчивость к нуклеофильной атаке. При этом основность карбонильного кислородного атома создает возможность дополнительного увеличения положительного заряда на карбонильном углероде за счет протонирования первого кислотами 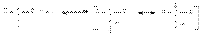 Благодаря этому карбонильный углерод может успешно атаковаться даже слабыми нуклеофилами. Подобная активация молекул карбонильных соединений реализуется в кислотном катализе реакций нуклеофильного присоединения по карбонильной группе. Во-вторых, слабость -связи в карбонильной группе обусловливает стехиометрический результат нуклеофильных реакций этих соединений: уходящей группой при нуклеофильной атаке является карбонильный атом кислорода, который сохраняет свою -связь с карбонильным углеродным атомом. В-третьих, электроноакцепторный характер карбонильной группы за счет –I и –M–эффектов обусловливает кислотность водородных атомов при соседних с ней углеродных атомов, что проявляется в способности последних отщеплять протон под действием сильных оснований
Благодаря этому карбонильный углерод может успешно атаковаться даже слабыми нуклеофилами. Подобная активация молекул карбонильных соединений реализуется в кислотном катализе реакций нуклеофильного присоединения по карбонильной группе. Во-вторых, слабость -связи в карбонильной группе обусловливает стехиометрический результат нуклеофильных реакций этих соединений: уходящей группой при нуклеофильной атаке является карбонильный атом кислорода, который сохраняет свою -связь с карбонильным углеродным атомом. В-третьих, электроноакцепторный характер карбонильной группы за счет –I и –M–эффектов обусловливает кислотность водородных атомов при соседних с ней углеродных атомов, что проявляется в способности последних отщеплять протон под действием сильных оснований 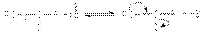 Можно видеть, что обоснованием кислотности водородных атомов при -углеродном атоме является стабилизация образующегося карбаниона за счет –I и –М–эффектов карбонильной группы.Подвижность атомов водорода при –углеродном атоме является предпосылкой для замещения этих атомов другими заместителями или группами, что находит свое выражение в реакциях –галогенирования и конденсации. В-четвертых, промежуточная степень окисления карбонильных групп (+1 в альдегидах и +2 в кетонах) обусловливает их способность к реакциям окисления и восстановления. Реакции нуклеофильного присоединения по карбонильной группе Стехиометрия реакций нуклеофильного присоединения реагента:NuH к карбонильному соединению представляется следующим уравнением
Можно видеть, что обоснованием кислотности водородных атомов при -углеродном атоме является стабилизация образующегося карбаниона за счет –I и –М–эффектов карбонильной группы.Подвижность атомов водорода при –углеродном атоме является предпосылкой для замещения этих атомов другими заместителями или группами, что находит свое выражение в реакциях –галогенирования и конденсации. В-четвертых, промежуточная степень окисления карбонильных групп (+1 в альдегидах и +2 в кетонах) обусловливает их способность к реакциям окисления и восстановления. Реакции нуклеофильного присоединения по карбонильной группе Стехиометрия реакций нуклеофильного присоединения реагента:NuH к карбонильному соединению представляется следующим уравнением 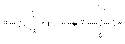 Как указывалось выше, атака нуклеофильного реагента на карбонильный атом углерода приводит к разрыву -связи карбонильной группы. Образующийся при этом интермедиат претерпевает дальнейшие превращения, приводящие к образованию продуктов нуклеофильного присоединения.Реакции нуклеофильного присоединения по карбонильной группе могут осуществляться при кислотном, основном катализе или некаталитически. В некаталитической реакции реализуется механизм:
Как указывалось выше, атака нуклеофильного реагента на карбонильный атом углерода приводит к разрыву -связи карбонильной группы. Образующийся при этом интермедиат претерпевает дальнейшие превращения, приводящие к образованию продуктов нуклеофильного присоединения.Реакции нуклеофильного присоединения по карбонильной группе могут осуществляться при кислотном, основном катализе или некаталитически. В некаталитической реакции реализуется механизм: 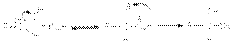 В случае кислотного катализа собственно нуклеофильной атаке предшествует протонирование субстрата:
В случае кислотного катализа собственно нуклеофильной атаке предшествует протонирование субстрата: 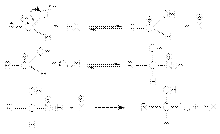
При основном катализе функция катализатора заключается в генерировании за счет кислотно-основного взаимодействия с реагентом более сильного нуклеофила, успешно атакующего карбонильный углерод: 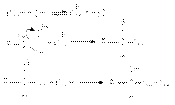 Примерами реакций нуклеофильного присоединения, реализуемых по одному из вышеприведенных механизмов являются: 1. Кислотно-каталитическая реакция образования ацеталей и полуацеталей
Примерами реакций нуклеофильного присоединения, реализуемых по одному из вышеприведенных механизмов являются: 1. Кислотно-каталитическая реакция образования ацеталей и полуацеталей 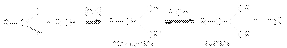
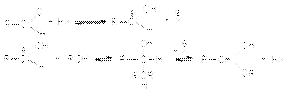 Вторичная реакция образования ацеталей является типичной кислотно-каталитической реакцией образования простого эфира
Вторичная реакция образования ацеталей является типичной кислотно-каталитической реакцией образования простого эфира
2. Образование гидратов альдегидов. 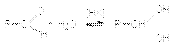 3. Взаимодействие с гидросульфитом (бисульфитом) натрия
3. Взаимодействие с гидросульфитом (бисульфитом) натрия 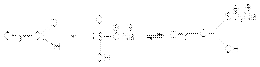 Катализатор в этой реакции не требуется, так как гидросульфит – анион в ионной паре соли является достаточно эффективным нуклеофильным агентом. Продукты присоединения гидросульфита с карбонильным соединением – хорошо кристаллизующиеся вещества, нерастворимые в водном растворе гидросульфита натрия. Поэтому их используют для отделения карбонильных соединений от веществ, с которыми гидросульфит натрия не вступает в реакции. При нагревании с раствором соды или щелочей полученные аддукты разлагаются с образованием сульфита натрия и регенерацией карбонильного соединения.
Катализатор в этой реакции не требуется, так как гидросульфит – анион в ионной паре соли является достаточно эффективным нуклеофильным агентом. Продукты присоединения гидросульфита с карбонильным соединением – хорошо кристаллизующиеся вещества, нерастворимые в водном растворе гидросульфита натрия. Поэтому их используют для отделения карбонильных соединений от веществ, с которыми гидросульфит натрия не вступает в реакции. При нагревании с раствором соды или щелочей полученные аддукты разлагаются с образованием сульфита натрия и регенерацией карбонильного соединения.  Следует отметить, что в реакцию с гидросульфитом натрия вступают только альдегиды и метилкетоны. 4. Замещение кислорода карбонильной группы на галогены. Галогенирующими агентами по отношению к альдегидам и кетонам выступают галогениды фосфора, серы и др.
Следует отметить, что в реакцию с гидросульфитом натрия вступают только альдегиды и метилкетоны. 4. Замещение кислорода карбонильной группы на галогены. Галогенирующими агентами по отношению к альдегидам и кетонам выступают галогениды фосфора, серы и др. 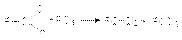
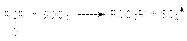 При взаимодействии с этими реагентами, которые являются сильными электрофилами, происходит активация карбонильного соединения, сопровождающаяся нуклеофильной атакой галогенид–аниона на карбонильный углерод
При взаимодействии с этими реагентами, которые являются сильными электрофилами, происходит активация карбонильного соединения, сопровождающаяся нуклеофильной атакой галогенид–аниона на карбонильный углерод 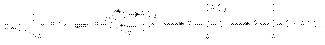 5. Взаимодействие с реактивами Гриньяра
5. Взаимодействие с реактивами Гриньяра 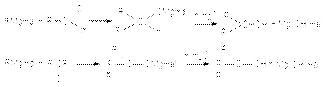 Поскольку в молекуле реактива Гриньяра углеводородный радикал имеет карбанионный характер, то он выступает в роли нуклеофильного агента по отношениюк карбонильному углероду субстрата
Поскольку в молекуле реактива Гриньяра углеводородный радикал имеет карбанионный характер, то он выступает в роли нуклеофильного агента по отношениюк карбонильному углероду субстрата 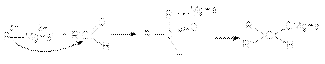 6. Образование циангидринов
6. Образование циангидринов 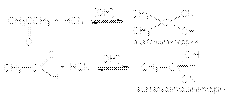 В этих реакциях роль основного катализа заключается в галогенировании эффективного нуклеофила:
В этих реакциях роль основного катализа заключается в галогенировании эффективного нуклеофила: 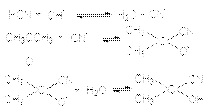 Продукты реакции, циангидрины, имеют практическое значение, связанное с получением мономеров для производства синтетических волокон и пластмасс – метакрилонитрила, метакриламида, метилметакрилата, акрилонитрила, акриламида, метилакрилата
Продукты реакции, циангидрины, имеют практическое значение, связанное с получением мономеров для производства синтетических волокон и пластмасс – метакрилонитрила, метакриламида, метилметакрилата, акрилонитрила, акриламида, метилакрилата 
7. Реакции нуклеофильного присоединения азотистых оснований. К этим реакциям относятся: а) образование иминов (азометинов) – оснований Шиффа 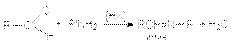 б) образование оксимов
б) образование оксимов 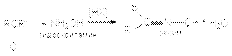 в) образование гидразонов
в) образование гидразонов 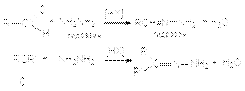
г) синтез семикарбазонов 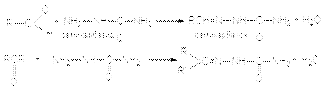 Все эти реакции протекают по единому механизму, причем кислотный катализ не только ускоряет первичный акт нуклеофильного присоединения, но и способствует эффективному отщеплению воды на последующих стадиях. Обозначив азотистое основание NH2X, можно представить общий механизм их взаимодействия с карбонильными соединениями при катализе кислотой HY:
Все эти реакции протекают по единому механизму, причем кислотный катализ не только ускоряет первичный акт нуклеофильного присоединения, но и способствует эффективному отщеплению воды на последующих стадиях. Обозначив азотистое основание NH2X, можно представить общий механизм их взаимодействия с карбонильными соединениями при катализе кислотой HY: 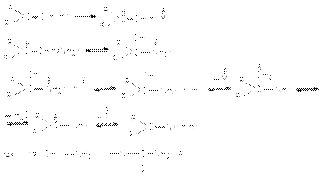 Реакционная способность карбонильных соединений в реакциях нуклеофильного присоединения Скорость-определяющей стадией реакций нуклеофильного присоединения по карбонильной группе является бимолекулярная атака реакционного центра субстрата нуклеофилом. Поэтому успех реакции определяется величиной частичного положительного заряда на карбонильном углероде и его пространственной доступностью. Поэтому реакционная способность карбонильных соединений падает по мере увеличения длины и разветвленности алкильного радикала при карбонильном углероде, а также при переходе от альдегидов к кетонам:
Реакционная способность карбонильных соединений в реакциях нуклеофильного присоединения Скорость-определяющей стадией реакций нуклеофильного присоединения по карбонильной группе является бимолекулярная атака реакционного центра субстрата нуклеофилом. Поэтому успех реакции определяется величиной частичного положительного заряда на карбонильном углероде и его пространственной доступностью. Поэтому реакционная способность карбонильных соединений падает по мере увеличения длины и разветвленности алкильного радикала при карбонильном углероде, а также при переходе от альдегидов к кетонам: 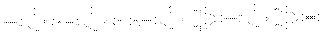 Можно видеть, что такое влияние связано с увеличением в этом ряду положительного индуктивного эффекта алкильных групп и с возрастанием пространственных препятствий для атаки на карбонильный углерод. Кето–енольная таутомерия, катализируемая основаниями и кислотами Кето-енольная таутомерия – форма изомерии, в которой изомеры (таутомеры) отличаются между собой расположением атомов водорода и кратностью связей между другими атомами. Для карбонильных соединений характерна таутомерия в связи с кислотными свойствами атомов водорода при -углеродном атоме и основностью карбонильного кислорода. Исходная карбонильная форма называется кето-формой, а его таутомер – енольной формой.
Можно видеть, что такое влияние связано с увеличением в этом ряду положительного индуктивного эффекта алкильных групп и с возрастанием пространственных препятствий для атаки на карбонильный углерод. Кето–енольная таутомерия, катализируемая основаниями и кислотами Кето-енольная таутомерия – форма изомерии, в которой изомеры (таутомеры) отличаются между собой расположением атомов водорода и кратностью связей между другими атомами. Для карбонильных соединений характерна таутомерия в связи с кислотными свойствами атомов водорода при -углеродном атоме и основностью карбонильного кислорода. Исходная карбонильная форма называется кето-формой, а его таутомер – енольной формой.  Взаимный переход таутомеров также называется кето-енольной таутомерией. Эта реакция катализируется основаниями и кислотами.
Взаимный переход таутомеров также называется кето-енольной таутомерией. Эта реакция катализируется основаниями и кислотами.
Основно-каталитическая реакция: 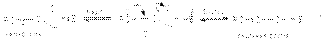 Кислотно-каталитическая реакция
Кислотно-каталитическая реакция 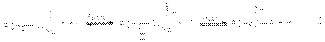 Присоединение протона к кислороду карбонильной группы резко облегчает отрыв протона от -углеродного атома вследствие большей электроноакцепторной способности положительно заряженного кислорода. Кето-енольная таутомерия играет важную роль во многих превращениях альдегидов и кетонов, так как енолы, а также интермедиаты I и II являются важнейшими интермедиатами в реакциях альдегидов и кетонов. Реакции окисления карбонильных соединений Альдегиды легко окисляются органическими окислителями (KMnO4 в нейтральной и кислой среде, K2Cr2O7 в кислой среде) до карбоновых кислот
Присоединение протона к кислороду карбонильной группы резко облегчает отрыв протона от -углеродного атома вследствие большей электроноакцепторной способности положительно заряженного кислорода. Кето-енольная таутомерия играет важную роль во многих превращениях альдегидов и кетонов, так как енолы, а также интермедиаты I и II являются важнейшими интермедиатами в реакциях альдегидов и кетонов. Реакции окисления карбонильных соединений Альдегиды легко окисляются органическими окислителями (KMnO4 в нейтральной и кислой среде, K2Cr2O7 в кислой среде) до карбоновых кислот 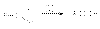 В промышленном масштабе окисление осуществляется кислородом воздуха
В промышленном масштабе окисление осуществляется кислородом воздуха 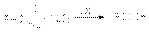 при катализе солями Mn4+, Co3+, Ni3+ и др.В качестве неорганических окислителей могут выступать также аммиачный раствор оксида серебра (реагент Толленса) и реактив Фелинга, который содержит комплексно связанный с винной кислотой Cu2+.
при катализе солями Mn4+, Co3+, Ni3+ и др.В качестве неорганических окислителей могут выступать также аммиачный раствор оксида серебра (реагент Толленса) и реактив Фелинга, который содержит комплексно связанный с винной кислотой Cu2+. 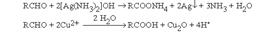 Выделяющиеся в первой реакции металлическое серебро и во второй – красный оксид меди (I) являются тестами на альдегидную группу. Кетоны к действию окислителей весьма устойчивы и окисляются лишь сильными окислителями при нагревании. Реакция имеет деструктивный характер: при окислении происходит разрыв С-С связи по обе стороны карбонильной группы
Выделяющиеся в первой реакции металлическое серебро и во второй – красный оксид меди (I) являются тестами на альдегидную группу. Кетоны к действию окислителей весьма устойчивы и окисляются лишь сильными окислителями при нагревании. Реакция имеет деструктивный характер: при окислении происходит разрыв С-С связи по обе стороны карбонильной группы 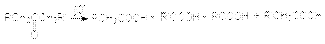 В этих реакциях используют те же окислители, что и при окислении альдегидов: неорганические окислители в препаративном органическом синтезе и кислород в промышленности. Окисление по Байеру-Виллигеру предполагает использование в качестве окислителей органических перкислот
В этих реакциях используют те же окислители, что и при окислении альдегидов: неорганические окислители в препаративном органическом синтезе и кислород в промышленности. Окисление по Байеру-Виллигеру предполагает использование в качестве окислителей органических перкислот 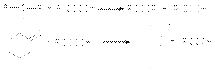 Реакции окислительно-восстановительного диспропорционирования В этих реакциях карбонильная группа проявляет двойственную функцию – окислителя и восстановителя. Реакция Канницциаро Альдегиды, которые не содержат водородных атомов при карбонильной группе реагируют в концентрированном водном растворе щелочи, давая 1 моль спирта и 1 моль карбоновой кислоты (в виде соли)
Реакции окислительно-восстановительного диспропорционирования В этих реакциях карбонильная группа проявляет двойственную функцию – окислителя и восстановителя. Реакция Канницциаро Альдегиды, которые не содержат водородных атомов при карбонильной группе реагируют в концентрированном водном растворе щелочи, давая 1 моль спирта и 1 моль карбоновой кислоты (в виде соли) 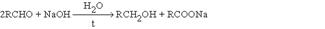 Механизм реакции связан с переносом гидрид-иона от активированного щелочью интермедиата к молекуле альдегида:
Механизм реакции связан с переносом гидрид-иона от активированного щелочью интермедиата к молекуле альдегида: 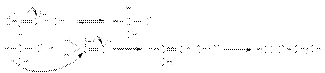 Поскольку формальдегид окисляется легче ароматических альдегидов возможна перекрестная реакция Канниццаро, в которой формальдегид окисляется в муравьиную кислоту, а ароматический альдегид восстанавливается до спирта
Поскольку формальдегид окисляется легче ароматических альдегидов возможна перекрестная реакция Канниццаро, в которой формальдегид окисляется в муравьиную кислоту, а ароматический альдегид восстанавливается до спирта 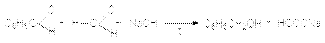 2. Реакция Тищенко.
2. Реакция Тищенко. 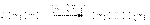
Реакции восстановления Промежуточная степень окисления карбонильных соединений обусловливает их способность к реакциям окисления и восстановления. В качестве восстановителей в реакциях восстановления используют молекулярный водород и гидридные комплексы алюминия и бора. Восстановление карбонильных соединений до спиртов. а) восстановление молекулярным водородом 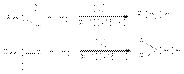 В качестве катализаторов этих реакций используют Ni, Pd, Pt,CuCrO2. б) восстановление гидридными комплексами металлов
В качестве катализаторов этих реакций используют Ni, Pd, Pt,CuCrO2. б) восстановление гидридными комплексами металлов 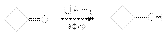 Эти методы находят применение в случае дорогостоящих или неустойчивых карбонильных соединений. В этих реакциях ключевой стадией является перенос гидрид-аниона от восстановления к карбонильному углеродному атому
Эти методы находят применение в случае дорогостоящих или неустойчивых карбонильных соединений. В этих реакциях ключевой стадией является перенос гидрид-аниона от восстановления к карбонильному углеродному атому
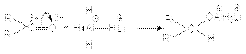 Можно полностью использовать все четыре атома водорода в литийалюминий гидриде:
Можно полностью использовать все четыре атома водорода в литийалюминий гидриде: 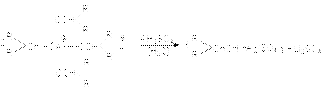 Преимущество литий алюминий гидрида состоит в том, что он селективно восстанавливает карбонильные группы, не затрагивая >C=C< связи. Он также восстанавливает карбонильные группы карбоновых кислот. Другой восстановитель NaBH4 - более мягкий. Он восстанавливает альдегиды и кетоны, но инертен по отношению к карбоновым кислотам и сложным эфирам.
Преимущество литий алюминий гидрида состоит в том, что он селективно восстанавливает карбонильные группы, не затрагивая >C=C< связи. Он также восстанавливает карбонильные группы карбоновых кислот. Другой восстановитель NaBH4 - более мягкий. Он восстанавливает альдегиды и кетоны, но инертен по отношению к карбоновым кислотам и сложным эфирам.
в) восстановление алкоголятами алюминия – реакция Меервейна-Понндорфа-Верлея-Оппенауэра 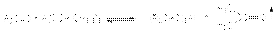 Смешение равновесия в этой реакции обеспечивается непрерывной отгонкой карбонильного продукта из реакционной массы. Восстановление карбонильных соединений до углеводородов. а) восстановление по Клемменсену. Если карбонильное соединение устойчиво к действию кислот, то используют этот тип восстановления
Смешение равновесия в этой реакции обеспечивается непрерывной отгонкой карбонильного продукта из реакционной массы. Восстановление карбонильных соединений до углеводородов. а) восстановление по Клемменсену. Если карбонильное соединение устойчиво к действию кислот, то используют этот тип восстановления 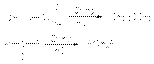 б) ион-радикальная димеризация альдегидов и кетонов. Если восстановление амальгамированным цинком или магнием осуществлять в нейтральной водной среде, то результатом реакции является образование пинаконов. Первой стадией этой реакции является перенос электрона от металла к карбонильной группе с последующей димеризацией ион-радикалов
б) ион-радикальная димеризация альдегидов и кетонов. Если восстановление амальгамированным цинком или магнием осуществлять в нейтральной водной среде, то результатом реакции является образование пинаконов. Первой стадией этой реакции является перенос электрона от металла к карбонильной группе с последующей димеризацией ион-радикалов 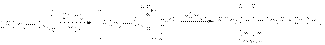 в) восстановление по Кижнеру-Вольфу Этот вид восстановления используется в тех случаях, когда объект восстановления устойчив к основаниям
в) восстановление по Кижнеру-Вольфу Этот вид восстановления используется в тех случаях, когда объект восстановления устойчив к основаниям 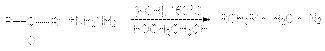 Альдольная конденсация Реакции альдольной конденсации могут быть представлены стехиометрическим уравнением
Альдольная конденсация Реакции альдольной конденсации могут быть представлены стехиометрическим уравнением 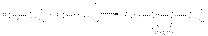 Реакция катализируется основаниями и кислотами. Механизм основно-каталитической альдольной конденсации может быть представлен следующими стадиями
Реакция катализируется основаниями и кислотами. Механизм основно-каталитической альдольной конденсации может быть представлен следующими стадиями 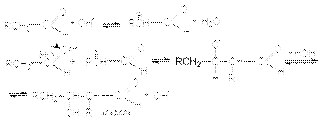 При нагревании образующийся продукт легко дегидрируется, образуя -ненасыщенные альдегиды
При нагревании образующийся продукт легко дегидрируется, образуя -ненасыщенные альдегиды 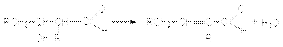 Стадия дегидратации протекает сравнительно легко благодаря двум причинам: 1) кислому характеру атома водорода при -углеродном атоме, 2) образованию стабильной системы сопряженных двойных связей.Механизм кислотно-каталитической альдольной конденсации может быть представлен стадиями:
Стадия дегидратации протекает сравнительно легко благодаря двум причинам: 1) кислому характеру атома водорода при -углеродном атоме, 2) образованию стабильной системы сопряженных двойных связей.Механизм кислотно-каталитической альдольной конденсации может быть представлен стадиями: 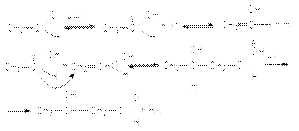
Присутствие кислоты - катализатора является дополнительным фактором дегидратации альдоля. Поэтому кислотно-каталитическую реакцию практически невозможно остановить на стадии образования альдоля ( -оксиальдегидами ). Альдольная конденсация двух различных альдегидов называется перекрестной альдольной конденсацией. Проводить перекрестную альдольную конденсацию двух альдегидов, содержащих водородные атомы при -углеродных атомах не имеет смысла, так как в результате такого синтеза получается смесь продуктов перекрестной конденсации и автоконденсации. Альдольную конденсацию двух различных карбонильных соединений можно осуществить, если на одно из них, не содержащее водородные атомы при -углероде и взятое в избытке, воздействовать другим, в структуре которого имеются водородные атомы при -углероде. Примером может служить конденсация формальдегида с уксусным ангидридом 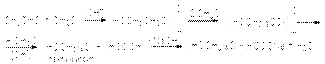 Получающийся многоатомный спирт, пентаэритрит, используется в качестве исходного вещества для получения полиэфирных смол. Поскольку кетоны гораздо более инертны к нуклеофильной атаке, то их можно использовать в перекрестных реакциях конденсации с альдегидами, не содержащими подвижные атомы водорода при -углеродном атоме. При этом реакцию необходимо проводить в условиях, неблагоприятных для кетон-кетонной конденсации. В частности, концентрация кетона в реакционной смеси должна быть низкой. Вариантом перекрестной альдольной конденсации можно считать реакцию Кнёвенагеля. В отличии от обычной альдольной конденсации здесь в качестве метиленовой компоненты используются соединения, содержащие при метиленовой группе две карбонильные группы или другие сильные электроакцепторные группы. Кислотность водородных атомов в этой метиленовой группе существенно выше чем у обычных соединений, что и обусловливает ее функцию метиленовой компоненты. Типичным примером этой реакции является взаимодействие альдегидов с малоновым эфиром:
Получающийся многоатомный спирт, пентаэритрит, используется в качестве исходного вещества для получения полиэфирных смол. Поскольку кетоны гораздо более инертны к нуклеофильной атаке, то их можно использовать в перекрестных реакциях конденсации с альдегидами, не содержащими подвижные атомы водорода при -углеродном атоме. При этом реакцию необходимо проводить в условиях, неблагоприятных для кетон-кетонной конденсации. В частности, концентрация кетона в реакционной смеси должна быть низкой. Вариантом перекрестной альдольной конденсации можно считать реакцию Кнёвенагеля. В отличии от обычной альдольной конденсации здесь в качестве метиленовой компоненты используются соединения, содержащие при метиленовой группе две карбонильные группы или другие сильные электроакцепторные группы. Кислотность водородных атомов в этой метиленовой группе существенно выше чем у обычных соединений, что и обусловливает ее функцию метиленовой компоненты. Типичным примером этой реакции является взаимодействие альдегидов с малоновым эфиром: 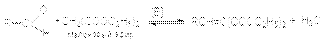 Механизм этой реакции реализуется через следующие стадии:
Механизм этой реакции реализуется через следующие стадии: 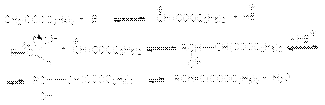 Смещение равновесия в этой реакции является отгонка воды из реакционной массы. Если в качестве метиленовой компоненты использовать малоновую кислоту, то открывается возможность синтеза -ненасыщенных кислот:
Смещение равновесия в этой реакции является отгонка воды из реакционной массы. Если в качестве метиленовой компоненты использовать малоновую кислоту, то открывается возможность синтеза -ненасыщенных кислот: 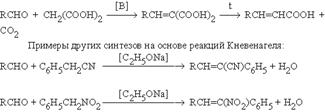 Альдольная конденсация кетонов Кетоны значительно труднее вступают в реакции альдольной автоконденсации по сравнению с альдегидами. Структурные условия здесь неблагоприятны как с точки зрения скорости, так и сточки зрения равновесия. Однако если реакцию проводить при кислотном катализе, то образующийся продукт конденсации будет быстро дегидратироваться, превращаясь в мезитилоксид. Эта последняя стадия смещает равновесие в сторону полного превращения кетона
Альдольная конденсация кетонов Кетоны значительно труднее вступают в реакции альдольной автоконденсации по сравнению с альдегидами. Структурные условия здесь неблагоприятны как с точки зрения скорости, так и сточки зрения равновесия. Однако если реакцию проводить при кислотном катализе, то образующийся продукт конденсации будет быстро дегидратироваться, превращаясь в мезитилоксид. Эта последняя стадия смещает равновесие в сторону полного превращения кетона 
 2015-06-05
2015-06-05 817
817








