=========================================================================
53. Алканы Изомерия Номенклатура. Пространственное и электронное строение предельныхуглеводородов. Методы получения алканов. Алка́ны (также насыщенные алифатические углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулойCnH2n+2. Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Простейшим представителем класса является метан (CH4) Номенклатура Рациональная 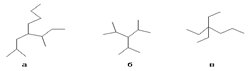 Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название «алкил1алкил2алкил3алкил4метан», например: а: н-бутил-втор-бутилизобутилметан б: триизопропилметан в: триэтилпропилметан Систематическая По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.[2] Например:
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название «алкил1алкил2алкил3алкил4метан», например: а: н-бутил-втор-бутилизобутилметан б: триизопропилметан в: триэтилпропилметан Систематическая По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.[2] Например: 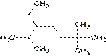 2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево) При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан. Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно. Восстановление галогенпроизводныхалканов: При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы[10]:
2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево) При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан. Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно. Восстановление галогенпроизводныхалканов: При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы[10]:  Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой: 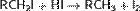 Восстановление спиртов: Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода
Восстановление спиртов: Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода 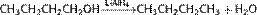 Восстановление карбонильных соединений Реакция Кижнера — Вольфа:
Восстановление карбонильных соединений Реакция Кижнера — Вольфа: 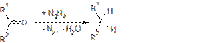 Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH[12].
Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH[12].
Реакция Клемменсена: 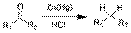 Гидрирование непредельных углеводородов Из алкенов
Гидрирование непредельных углеводородов Из алкенов 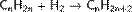 Из алкинов
Из алкинов 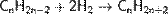 Катализатором реакции являются соединения никеля, платины или палладия[14]. Синтез Кольбе При электролизе солей карбоновых кислот, анион кислоты — RCOO− перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R—R. Например:
Катализатором реакции являются соединения никеля, платины или палладия[14]. Синтез Кольбе При электролизе солей карбоновых кислот, анион кислоты — RCOO− перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R—R. Например: 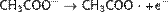
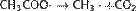
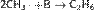 Газификация твердого топлива (Процессы Бертло, Шрёдера, Бергиуса) Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса):
Газификация твердого топлива (Процессы Бертло, Шрёдера, Бергиуса) Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса): 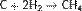
Реакция Вюрца 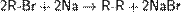
54). физические и химические свойства алканов реакции радикального замещения и их значение Физические свойства Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях неразветвлённыеалканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; начиная с C14H30 и далее — твёрдые вещества.Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, анеопентан — газ.Газообразныеалканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла. Химические свойства Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
55). Нефть. Переработка нефти.Фракционная перегонка. Крекинг и виды крекинг-процесса. Важнейшие нефтепродукты. Нефть — природная маслянистая горючая жидкость со специфическим запахом, состоящая в основном из сложной смеси углеводородов различной молекулярной массы и некоторых других химических соединений. Относится к каустобиолитам[10] (ископаемое топливо[11]).Нефть обнаруживается вместе с газообразными углеводородами на глубинах от десятков метров до 5—6 км.содержит простейшие углеводороды бутан (С4Н10), гексан (С6Н14) и пентан (С5Н12). Спустя некоторое время российский ученый В. В. Марковников в процессе исследования обнаружил в нефти достаточное количество циклических насыщенных углеводородов — циклопентана (С5Н10) и циклогексана (С6Н12). На сегодняшний день установлено, что нефть и нефтепродукты соответственно имеют в своем составе более одной тысячи различных веществ, но некоторые из них представлены в малом количестве. Стоит отметить, что в данном веществе содержатся алициклические, насыщенные, ненасыщенные и ароматические углеводороды, имеющие разнообразное строение. В состав нефти также могут входить соединения азота, серы, а также кислородсодержащие соединения (фенолы и кислоты).- Цель переработки нефти — производство нефтепродуктов, прежде всего различных видов топлива (автомобильного, авиационного, котельного и т. д.) и сырья для последующей химической переработки.В настоящее время технология переработки нефти включает в себя такие процессы: однократная перегонка нефти и ратификация смесей. К ней часто применяются обобщенные наименования. В процессе разделения нефти путем перегонки и ратификации получают фракции и дистилляты. Они выкипают при определенных температурах и представляют собой довольно сложные смеси. При этом отдельные фракции нефти в некоторых случаях состоят из небольшого количества компонентов, значительно различающихся температурами кипения. По этой причине смеси могут классифицироваться на дискретные, непрерывные и дискретно-непрерывные. Методы переработки нефти. Фракционная перегонка Главным методом переработки является фракционная перегонка нефти. Данная процедура подразумевает разделение вещества на фракции, которые отличаются по составу. Дистилляция основана на различии в температурах кипения компонентов нефти. Фракция представляет собой химическую часть вещества с одинаковыми физическими и химическими свойствами, которая выделяется в процессе перегонки. Прямая перегонка представляет собой физический метод переработки нефти с применением атмосферно-вакуумной установки.- Продукты переработки нефти К продуктам переработки относится парафин, вазелин, церезин, различные масла и прочие вещества с выраженными водоотталкивающими свойствами. Благодаря данной особенности их применяют для изготовления чистящих средств и кремов. Так называемая первичная перегонка нефти выполняется благодаря естественному напору подземных вод, которые располагаются под нефтяной залежью. Под давлением нефть будет поднята на поверхность с глубины. Ускорить процедуру можно с применением насосов. Данная процедура позволяет добыть около 25-30% нефти. Для вторичной добычи в нефтяной пласт в основном накачивают воду или же нагнетают диоксид углерода. В результате этих действий на поверхность можно вытеснить еще примерно 35% вещества. В процессе первичной перегонки нефти и вторичной термической переработки выделяются продукты перегонки нефти, в которых содержится сероводород. В значительной степени это зависит от условий предварительной сепарации нефти, а также эксплуатируемых месторождений. Содержание в составе нефти сероводорода является важным показателем, определяющим множество факторов. Крекинг Увеличить выход бензиновых фракций можно благодаря применению крекинг-процессов для переработки нефти. Крекинг представляет собой процесс перегонки нефти и нефтепродуктов, который основан на расщеплении молекул сложных углеводородов в условиях высоких давлений и температур. В 1875 году крекинг был впервые предложен А.А. Летним, российским ученым, после чего он был разработан в 1891 году В.Г. Шуховым. Несмотря на это, первая промышленная установка, в которой предусматривалась прямая перегонка, была сооружена в США. Крекинг делится на следующие виды: термический, каталитический, гидрокрекинг и каталитический риформинг. Термический крекинг применяется для образования бензина, керосина и дизельного топлива. К примеру, при температуре до 500°С и давлении 5 МПа имеющийся в составе дизельного топлива и керосина углеводород цетан разлагается на вещества, которые входят в состав бензина. Термический крекинг Бензин, создаваемый путем термического крекинга, обладает невысоким октановым числом и большим содержанием непредельных углеводородов. Из этого можно сделать вывод, что бензин имеет плохую химическую стабильность. Поэтому его будут применять только в качестве компонента для образования товарных бензинов. На сегодняшний день установки для термического крекинга не сооружаются. Это объясняется тем, что с их помощью получают продукты перегонки нефти, которые в условиях хранения окисляются. В них образовываются смолы, поэтому в вещество вводят специальные присадки, предназначенные для снижения степени осмоления. Каталитический крекинг Каталитический крекинг представляет собой процесс перегонки нефти для получения бензина, который основан на расщеплении углеводородов и изменении их структуры, что происходит благодаря катализатору и высоким температурам. Впервые каталитический крекинг был осуществлен в 1919 году в России на заводской установке. При каталитическом крекинге в качестве сырья применяют фракции соляра и газойля, которые образуются в случае прямой перегонки нефти. Их нагревают до температуры около 500°С при соблюдении давления 0,15 МПа с использованием алюмоселикатного катализатора. Он позволяет ускорить процедуру расщепления молекул сырья и превращает продукты распада в ароматические углеводороды. Прямая перегонка позволяет бензинам иметь большее октановое число, нежели при термическом крекинге. Продукты каталитического крекинга представляют собой обязательные составляющие топлива марки А-72 и А-76. Гидрокрекинг представляет собой процедуру переработки, которая распространяется на нефть и нефтепродукты. Он состоит из крекирования и гидрирования сырья. Его выполняют в условиях температуры около 400°С и давления водорода до 20 МПа. При этом используются специальные молибденовые катализаторы. В таком случае октановое число бензиновых фракций будет еще больше. Данный процесс также способен повысить выход светлых нефтепродуктов, таких как реактивное и дизельное топливо, бензин
=========================================================================
56). Алкены. Гомологический ряд, изомерия, номенклатура. Электронное строение этиленовых УВ. Методы получения алкенов. Алкены содержат двойную углерод- углеродную связь, их называют еще олефинами (образующие масла). Углеводороды с общей формулой CnH2n, в молекулах которых между атомами углерода имеется одна двойная связь, называют углеводородами ряда этилена, или алкенами. Так как в гибридизации участвуют s - электрон и два p - электрона, то такой ее вид называется sp2 - гибридизацией. Валентный угол: 120 градусов. Формулы углеводородов ряда этилена можно вывести из соответствующих формул предельных углеводородов. Названия углеводородов ряда этилена образуют путем изменения суффикса -ан соответствующего предельного углеводорода на -ен или -илен. Гомологический ряд этилена C2H4 - Этилен (Этен) C3H6 - Пропилен (Пропен) C4H8 – Бутен C5H10 – Пентен C6H12 – Гексен C7H14 – Гептен C8H16 – Октен C9H18 – Нонен C10H20 – Децен Алкены могут образовывать пространственные, так называемые геометрические изомеры. Отличаются расположением заместителей относительно двойной связи: в цис- изомере оба заместителя расположены по одну сторону, в транс- изомере- по разные стороны от двойной связи.Общая формула гомологического ряда алкенов СnН2n. Она совпадает с общей формулой циклоалкана, поэтому алкены и циклоалканы являются межклассовыми изомерами. При отщеплении атома водорода от молекул алкенов образуются непредельные радикалы обшей формулы CnH2n-1, простейшие из которых — винил (этенил) и аллил (пропенил):
| СН2=СН- | СН2=СН-СН2- |
| винил | аллил |
Если каждый из атомов углерода при связи С=С связан с двумя разными заместителями, то эти заместители могут располагаться по одну сторону от плоскости двойной связи (цис-изомер) или по разные стороны (транс-изомер), например: 
цис-бутен-2 транс-бутен-2 Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва p-связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры представляют собой разные индивидуальные вещества, которые отличаются друг от друга физическими и химическими свойствами. Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис-транс-изомеров. Структрурная изомерия в ряду алкенов представлена изомерией цепи и изомерией положения двойной связи. Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8): 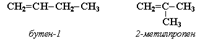
2. Изомерия положения двойной связи (начиная с С4Н8): 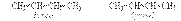
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:  В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения. 1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения. 1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
| t | ||
| С8Н18 | → | С4Н10 + С4Н8 |
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С). 2. Другой промышленный способ получения алкенов - дегидрирование алканов:
| t, Cr2O3 | ||
| СН3-СН2-СН3 | → | СН3-СН=СН2 + Н2 |
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная p-связь. К таким реакциям относятся следующие. 1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
| H2SO4 | ||
| СН3-СН2-ОН | → | СН2=СН2 + Н2О |
| Действие спиртовых растворов едких щелочей на галогенпроизводные |
H3C-CH2-CH2Br 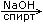 H3C-CH=CH2+NaBr+H2O H3C-CH=CH2+NaBr+H2O |
=========================================================================
57). Химические свойства алкенов. Электрофильный механизм реакций присоединения. Правило В.В. Морковникова. ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ.
| 1.Присоединение галогенов |
CH2=CH-CH3+Cl2 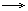 CH2Cl-CHCl-CH3 CH2Cl-CHCl-CH3 |
| 2.Присоединение водорода |
CH2=CH-CH3+Н2 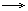 CH3-CH2-CH3 CH3-CH2-CH3 |
| 3.Присоединение галогенводородов |
CH2=CH-CH3+НCl 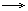 CH3-CHCl-CH3 Присоединение протекает по правилу Марковникова(водород присоединяется к наиболее гидрогенизированному атому углерода) CH3-CHCl-CH3 Присоединение протекает по правилу Марковникова(водород присоединяется к наиболее гидрогенизированному атому углерода) |
| 4.Присоединение воды |
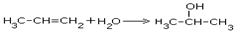 |
| 5.Окисление перманганатом калия в нейтральной или слабощелочной среде(реакция Вагнера) |
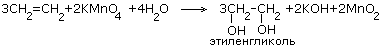 |
| 6.Полимеризация алкенов |
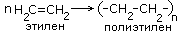 |
В настоящее время правило Марковникова звучит так: при присоединению к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х – это атом I, Br, Cl, F или гидроксильная группа ОН-) атом водорода становится к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х – к наименее гидрогенизированному. Правило Марковникова: примеры Для того чтобы вам стал понятнее смысл правила Марковникова давайте рассмотрим его на конкретных примерах. CH3-CH=CH2 + HCl ==== CH3-CHCl-CH3 В данной реакции происходит присоединение к пропену хлороводорода с образованием 2-хлор пропана. Как вы видите в ходе этой реакции, произошел разрыв двойной связи и хлор присоединился к менее гидрогенизированному атому углерода, т.е. к тому у которого имеется меньше водородных связей, а водород соответственно к более гидрогенизированному.Аналогичным образом будет протеать и реакция гидротации, т.е. присоединения молекул воды. Исключения из правила Марковникова В некоторых случаях реакция присоединения протекает против правила Марковникова. Например, в случае если в реакцию вступают соединения, у которых атом углерода у двойной связи имеет сопряженную связь с электроотрицательной группировкой, оттягивающей на себя частично электронную плотность.
Присоединение против правила Марковникова будет наблюдаться и в химических реакциях с радикальным механизмом. Примером такой реакции является присоединение бромоводорода к олефинам. Эта реакция протекает в присутствии перекиси и называется еще эффектом Хариша. Рассмотрим эту реакцию подробнее: под воздействием перекиси из бромоводорода выделяется атомарный бром, который и является активной атакующей частицей. Данная реакция имеет свободно радикальный механизм и протекает в направлении образования наиболее стабильных вторичных радикалов. При этом реакции по правилу Марковникова протекают с меньшими энергетическими затратами, чем присоединение идущее против этого правила.
========================================================================
58). Ацетиленовые углеводороды. Гомологический ряд. Изомерия и номенклатура. Электронное строение и геометрия алкинов. Кислотные свойства ацетилена. Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью. Общая формула: CnH2n–2, где n > 2. Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома. Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи. Первые два члена гомологического ряда – этин и пропин – изомеров не имеют. Для бутинов возможен только один вид изомерии – изомерия положения тройной связи. Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен. Физические свойства алкинов: 1) С2Н2…С4Н6 – газы; 2) С5Н8…С15Н28 – жидкости; 3) С16Н30… – твердые вещества; 4) плохо растворимы в воде. Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p- орбитали остаются негибридными.  sp- Гибридные орбитали двух атомов углерода в состоянии, предшествующем образованию тройной связи и связей C–H По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию s- связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s- орбиталью атома водорода, образуя s- связь С–Н.
sp- Гибридные орбитали двух атомов углерода в состоянии, предшествующем образованию тройной связи и связей C–H По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию s- связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s- орбиталью атома водорода, образуя s- связь С–Н. 
 Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях) Две негибридные p- орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению s- связей, взаимно перекрываются и образуют две p- связи. Таким образом, тройная связь характеризуется сочетанием одной s- и двух p- связей. Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой молекулы реагента остается еще одна p- связь (алкин превращается в алкен), которая вновь может вступать в реакцию присоединения со второй молекулой реагента. Кроме того, "незамещенные" алкины проявляют кислотные свойства, связанные с отщеплением протона от атома углерода, составляющего тройную связь (єС–Н). Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s-связи: ≡ С← Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами: R - C ≡ C-H + NaH → R-C ≡ C - Na + Н2 Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эти реакции служат для обнаружения алкинов с тройной связью на конце цепи.
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях) Две негибридные p- орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению s- связей, взаимно перекрываются и образуют две p- связи. Таким образом, тройная связь характеризуется сочетанием одной s- и двух p- связей. Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой молекулы реагента остается еще одна p- связь (алкин превращается в алкен), которая вновь может вступать в реакцию присоединения со второй молекулой реагента. Кроме того, "незамещенные" алкины проявляют кислотные свойства, связанные с отщеплением протона от атома углерода, составляющего тройную связь (єС–Н). Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s-связи: ≡ С← Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами: R - C ≡ C-H + NaH → R-C ≡ C - Na + Н2 Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эти реакции служат для обнаружения алкинов с тройной связью на конце цепи.
| НС ≡ СН + 2[Ag(NH3)2]OH → Ag-C ≡ C-Ag | ↓ | + 2NH3 + Н2O |
| белый осадок |
| R-C ≡ CH + [Cu(NH3)2]Cl → R-C ≡ C- Cu | ↓ | + NH4Cl + NH3. |
| красный осадок |
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина: R-C = C-Cu + HCl → R-C = CH + CuCl. Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
--========================================================================
59). Химические свойства алкинов. Реакции присоединения, их механизмы. Реакции присоединения: 1) Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью. CH3–CCH(пропин) ––t,Pd;H2• CH3–CH=CH2(пропен) ––t,Pd;H2 CH3–CH2–CH3(пропан) 2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HCCH ––Br2 CHBr=CHBr(1,2- дибромэтен) ––Br2 CHBr2–CHBr2(1,1,2,2- тетрабромэтан)
3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова. CH3–CCH ––HBr CH3–CBr=CH2(2- бромпропен -1) ––HBr CH3–CBr2–CH3(2,2- дибромпропан) 4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 году М.Г.Кучеров. Присоединение воды идет по правилу Марковникова, образующийся при этом неустойчивый спирт с гидроксильной группой при двойной связи (так называемый, енол) изомеризуется в более стабильное карбонильное соединение - кетон.
| C2H5–CCH + H2O ––HgSO4 [C2H5– | C=CH2](енол) C2H5– I OH | C–CH3(метилэтилкетон) II O |
В случае гидратации собственно ацетилена конечным продуктом является альдегид.
| O II | ||
HCCH + H2O ––HgSO4 [CH2=  | CH](енол) CH3– I | C(уксусный альдегид) I |
| H | O | H |
5) Полимеризация. Ацетиленовые углеводороды ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях: a) Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена. HCCH ––kat.HCCH CH2=CH–CCH ––kat.HCCH CH2=CH–CC–CH=CH2 b) При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола.
 +
+  ––600C,C
––600C,C 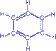
=================================================================================
60). Современные представления о строении диеновых углеводородов с сопряженными связями. Промышленные способы получения алкадиенов. Дие́ны (диеновые углеводороды) — ненасыщенные углеводороды с открытой цепью, содержащие в молекуле две двойные связи и образующие гомологический ряд общей формулы CnH2n−2. Диены являются структурными изомерами алкинов. Сопряжённые диены или 1,3-диены — замещённые производные бутадиена-1,3 CH2=CH–CH=CH2 Физические свойства. Бутадиен-1,3 — легко сжижающийся газ с неприятным запахом. Изопрен — жидкость с tкип 34 °С. Получение. Основной промышленный способ получения диенов — дегидрирование алканов. Бутадиен-1,3 (дивинил) получают из бутана:
| t,Сr2О3 | ||
| СН3-СН2-СН2-СН3 | → | СН2=СН-СН=СН2 + 2Н2, |
а изопрен (2-метилбутадиен-1,3) — из 2-метилбутана:
| t, Сr2О3 | ||
| СН3-СН(СН3)-СН2-СН3 | → | СН2=С(СН3)-СН=СН2+2Н2. |
Сопряжение — образование единого электронного облака в результате взаимодействия негибридизованных р-орбиталей в молекуле с чередующимися двойными и одинарными связями.
Большой интерес представляют диены с сопряженными двойными связями, так как они имеют некоторые свойства, обусловливающие их широкое применение в химической промышленности. Особые свойства таких диеновых углеводородов объясняются их электронным строением. Бутадиен-1,3 можно также получать по реакции Лебедева путем одновременного дегидрирования и дегидратации этанола:
| t, ZnO, Al2O3 | ||
| 2С2Н5ОН | → | СН2=СН-СН=СН2 + Н2 + 2Н2О. |
Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 - гибридном состоянии, что означает расположение этих атомов в одной плоскости и наличие у каждого из них одной p- орбитали, занятой одним электроном и расположенной перпендикулярно к упомянутой плоскости. 
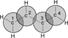
| a) | b) |
| Схематическое изображение строения молекул дидивинила (а) и вид модели сверху (b). Перекрывание электронных облаков между С1–С2 и С3–С4 больше, чем между С2–С3. |
p- Орбитали всех атомов углерода перекрываются друг с другом, т.е. не только между первым и вторым, третьим и четвертым атомами, но и также между вторым и третьим. Отсюда видно, что связь между вторым и третьим атомами углерода не является простой s- связью, а обладает некоторой плотностью p- электронов, т.е. слабым характером двойной связи. Это означает, что s- электроны не принадлежат строго определенным парам атомов углерода. В молекуле отсутствуют в классическом понимании одинарные и двойные связи, а наблюдается делокализация p- электронов, т.е. равномерное распределение p- электронной плотности по всей молекуле с образованием единого p- электронного облака. Взаимодействие двух или нескольких соседних p- связей с образованием единого p- электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения. Таким образом, молекула бутадиена -1,3 характеризуется системой сопряженных двойных связей. Такая особенность в строении диеновых углеводородов делает их способными присоединять различные реагенты не только к соседним углеродным атомам (1,2- присоединение), но и к двум концам сопряженной системы (1,4- присоединение) с образованием двойной связи между вторым и третьим углеродными атомами. Отметим, что очень часто продукт 1,4- присоединения является основным.
 2015-06-05
2015-06-05 933
933








