Рис. 77. ИЗОТЕРМЫ ВАН-ДЕР-ВААЛЬСА.
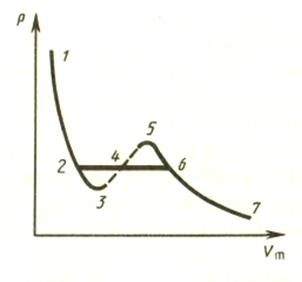
При высоких температурах (Т > Тк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой.При температуре Тк на изотерме имеется лишь одна точка перегиба К. Этой температуре соответствуют: объем Vk и давление pk. Состояние с параметрами (Vk, pk, Tk) называется критическим. При низких температурах (Т < Tk) изотермы имеют волнообразный участок, сначала монотонно опускающийся вниз, затем монотонно поднимающийся вверх и снова опускающийся. Преобразуем уравнение Ван-Дер-Ваальса к виду
pVm3 - (RT + pb)Vm2 + aVm -ab = 0. (15.18.)
При заданныхзначениях p и T, это уравнение третьей степени относительно Vm; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, физический смысл имеют лишь вещественные положительные корни. Первому случаю соответствуют изотермы при низких температурах (три значения объема газа V1, V2, V3 отвечают одному значению давления р1), второму случаю — изотермы при высоких температурах. Рассматривая различные участки изотермы при Т < Tk, видим, что на участках 1 - 3 и 5 - 7 при уменьшении объема V давление p возрастает, что естественно. На участке 3 - 5 сжатие вещества приводит к уменьшению давления; практика показывает, что такие состояния в природе не встречаются. Наличие участка
3 - 5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Истинная изотерма будет иметь вид ломаной линии 7 -6 -2 -1. Часть 7 - 6 отвечает газообразному состоянию, а часть 2 - 1 - жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6 - 2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии превращается в жидкость. Газ, же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
 2015-06-05
2015-06-05 300
300








