Наряду с поверхностной активностью для характеристики ПАВ используют еще один термодинамический параметр – работу адсорбции.
Работа адсорбции (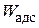 ) – работа перемещения 1 моль ПАВ из объема раствора в поверхностный слой при Т = const:
) – работа перемещения 1 моль ПАВ из объема раствора в поверхностный слой при Т = const: 
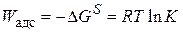 , (3.38)
, (3.38)
где 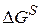 – свободная поверхностная энергия; К – константа адсорбционного равновесия.
– свободная поверхностная энергия; К – константа адсорбционного равновесия.
Рассчитаем разность работ адсорбции для двух соседних членов гомологического ряда:
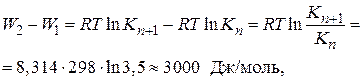
где Кn+ 1/ Kn =3,0–3,5 (по правилу Дюкло – Траубе).
Таким образом, для перевода каждой –СН2-группы из поверхностного слоя в объемную фазу надо затратить около 3 кДж/моль. Это работа раздвижения дипольных молекул воды (на величину –СН2-группы). Так как размер группы –СН2– один и тот же, то работа адсорбции одна и та же. Следовательно, носителем поверхностной активности ПАВ является углеводородный радикал.
3.3.6. Расчет гиббсовской адсорбции из изотермы
поверхностного натяжения методом графического
дифференцирования
Зная зависимость поверхностного натяжения раствора от концентрации растворенного вещества, можно рассчитать изотерму адсорбции ПАВ методом графического дифференцирования экспериментальной кривой σ = f (C). Для этого в нескольких точках кривой σ = f (C) проводят касательные и определяют тангенсы угла их наклона, которые соответствуют значениям производных d σ / dС в этих точках (рис. 3.28). Зная значения этих производных, по уравнению адсорбции Гиббса рассчитывают величины Г, что позволяет построить изотерму адсорбции Г = f (C).
Из рис. 3.28 видно, что:
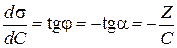 .
.
Подставим полученное значение в уравнение Гиббса (3.39):
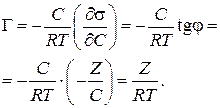 (3.39)
(3.39)
Таким способом рассчитывают величины адсорбции Г для ряда точек на кривой и по рассчитанным данным строят изотерму адсорбции в координатах Г = f (C), (рис. 3.29).
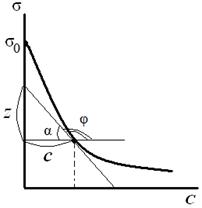 | 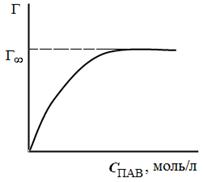 |
| Рис. 3.28. Графическое дифференцирование изотермы поверхностного натяжения | Рис. 3.29. Изотерма адсорбции в координатах Г = f (C) |
3.3.7. Применение уравнения изотермы Лэнгмюра
к адсорбции на границе жидкость–газ.
Расчет молекулярных характеристик исследуемого ПАВ
Уравнение изотермы мономолекулярной адсорбции Лэнгмюра для адсорбции на границе жидкость – газ (3.34) позволяет определить молекулярные характеристики ПАВ в поверхностном слое. Для этого:
1. Уравнение Лэнгмюра приводят к линейному виду:
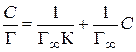 . (3.40)
. (3.40)
2. Строят изотерму адсорбции в координатах линейной формы уравнения Лэнгмюра (рис. 3.30).
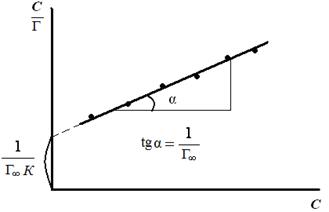
Рис. 3.30. Изотерма адсорбции
в координатах линейной формы уравнения Лэнгмюра
3. Определяют емкость адсорбционного монослоя как котангенс угла наклона прямой линии:
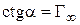 .
.
4. Зная значение 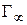 , определяют площадь, занимаемую одной молекулой ПАВ в насыщенном адсорбционном слое на границе раздела фаз(
, определяют площадь, занимаемую одной молекулой ПАВ в насыщенном адсорбционном слое на границе раздела фаз(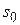 ):
):
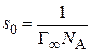 , (3.41)
, (3.41)
а также длину молекулы ПАВ (δ):
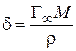 , (3.42)
, (3.42)
где 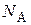 – число Авогадро 6,022·1023 моль–1; М – молярная масса ПАВ;
– число Авогадро 6,022·1023 моль–1; М – молярная масса ПАВ;
ρ– плотность ПАВ.
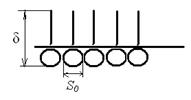
Рис. 3.31. Молекулярные характеристики ПАВ
Согласно исследованиям Лэнгмюра, площадь, занимаемая одной молекулой большинства одноосновных кислот, составляет 0,20 нм2, для спиртов – 0,25 нм2. Толщина адсорбционного монослоя (δ) пропорциональна числу атомов углерода в молекуле, при этом величина 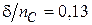 нм для всего гомологического ряда, где nC – число атомов углерода в молекуле.
нм для всего гомологического ряда, где nC – число атомов углерода в молекуле.
Пример 3.5. При исследовании поверхностной активности растворов уксусной кислоты при 20 °С были получены следующие данные:
| С, моль/л | 0,0 | 0,01 | 0,1 | 0,5 | 1,0 |
| σ · 103, Дж/м2 | 72,75 | 70,02 | 66,88 | 61,66 | 57,28 |
Найдите площадь, занимаемую одной молекулой кислоты и толщину адсорбционного слоя (длину молекулы).
Решение:
1. По экспериментальным данным строим изотерму поверхностного натяжения и проводим ее графическое дифференцирование. Для этого из нескольких точек кривой σ = f (C) проводим касательные до пересечения их с осью ординат и прямые, параллельные оси абсцисс. Получим отрезок Z, отсекаемый на оси ординат проведенными линиями.
2. Полученные значения Z при различных значениях С занесем в таблицу. Заполнение таблицы продолжим после проведения дальнейших расчетов.
| С, моль/л | Z· 103,Дж/м2 | Г·106,моль/м2 |  |
| 0,1 | 68,8 – 66 = 2,8 | 1,13 | 8,85 |
| 0,15 | 67,8 – 64,5 = 3,3 | 1,33 | 11,28 |
| 0,2 | 66,4 – 62,9 = 3,5 | 1,41 | 14,18 |
| 0,3 | 65,2 – 61,6 = 3,6 | 1,45 | 20,69 |
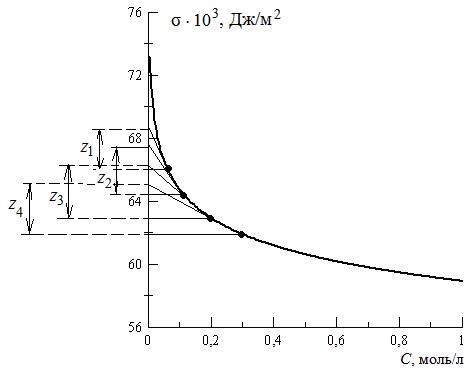
Рис. 3.32. Графическое дифференцирование
изотермы поверхностного натяжения
3. Вычислим значение величины адсорбции Г по уравнению (3.39) для С = 0,1 моль/л:
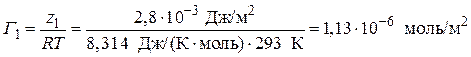 .
.
Аналогичный расчет проведем для других концентраций. Полученные результаты занесем в таблицу.
4. По полученным результатам расчетов, приведенных в таблице, строим изотерму адсорбции Лэнгмюра в координатахГ = f (C).
5. Рассчитываем значения 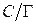 для С = 0,1 моль/л:
для С = 0,1 моль/л:
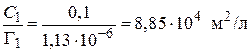 .
.
Аналогичный расчет проведем для других значений С. Полученные результаты занесем в таблицу.
6. Для нахождения величины предельной адсорбции Г ∞ строим изотерму адсорбции в координатах линейной формы уравнении Лэнгмюра 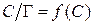 .
.
7. Экстраполяция прямой до оси ординат дает отрезок, равный 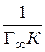 , тангенс угла наклона прямой равен
, тангенс угла наклона прямой равен 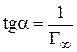 .
.
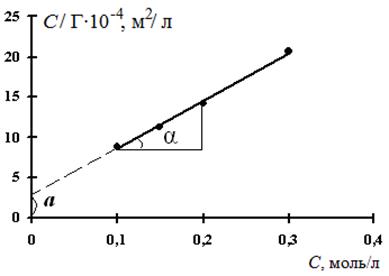
Рис. 3.33. Изотерма адсорбции
в координатах линейной формы уравнения Лэнгмюра
8. Рассчитываем константы уравнения Лэнгмюра:
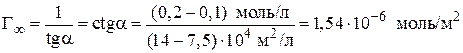 .
.
9. Зная величину 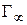 , определим молекулярне характеристики ПАВ:
, определим молекулярне характеристики ПАВ: 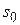 и δ:
и δ:
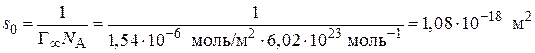 .
.
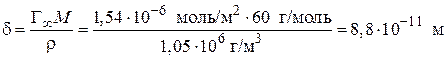 .
.
Пример 3.6. При 293 К зависимость поверхностного натяжения от концентрации водного раствора пропилового спирта выражается уравнением Шишковского: 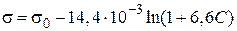 . Определите адсорбцию пропилового спирта на поверхности раздела водный раствор – воздух при концентрации 0,25 моль/л.
. Определите адсорбцию пропилового спирта на поверхности раздела водный раствор – воздух при концентрации 0,25 моль/л.
Решение. Из приведенного уравнения Шишковского следует, что
А = 6,6, В = 14,4·10–3.
Подставим константы уравнения Шишковского в уравнение (3.42):
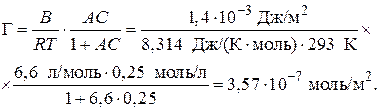
Пример 3.7. При адсорбционном насыщении при 293 К площадь, занимаемая молекулой изо-бутилового спирта равна 2,97·10–19 м2. Вычислите постоянную В в уравнении Шишковского и величину предельной адсорбции на поверхности раздела фаз.
Решение:
1. Вычислим величину предельной адсорбции:
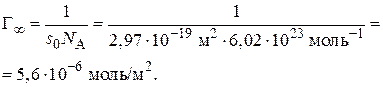 .
.
2. Вычислим величину постоянной В в уравнении Шишковского:
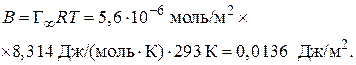
 2015-06-05
2015-06-05 10928
10928
