Во всяком процессе коагуляции различают две стадии:
Скрытая коагуляция – невооруженным глазом нельзя наблюдать каких-либо внешних признаков происходящих изменений в золе.
Явная коагуляция – о коагуляции можно судить невооруженным глазом: по помутнение, по выпадению осадка, по изменению цвета.
Для лиофобных золей характерно то, что стадия скрытой коагуляции очень коротка и быстро переходит в стадию явной коагуляции.
5.2.1. Кинетика коагуляции. Теория кинетики
быстрой коагуляции Смолуховского
В качестве меры агрегативной устойчивости дисперсной системы можно рассматривать скорость ее коагуляции.
Скорость коагуляции – изменение частичной концентрации дисперсных частиц в единице объема в единицу времени.
Скорость коагуляции может быть самой разной в различных системах (от нескольких секунд до нескольких лет). Система тем более устойчива, чем медленнее она коагулирует.
Различают: быструю коагуляцию, при которой каждое столкновение частиц приводит к их слипанию (все соударения эффективны); и медленную коагуляцию, когда не все столкновения частиц являются эффективными.
Теория кинетики быстрой коагуляции однородных сферических частиц была разработана польским ученым М. Смолуховским в 1916 г.
Основные положения теории быстрой коагуляции Смолуховского:
· частицы дисперсной фазы сближаются в результате броуновского движения, слипаются, образуют агрегат, который совершает дальнейшее броуновское движение как единое целое;
· скорость сближения частиц определяется коэффициентом диффузии и средним расстоянием между частицами;
· в каждом элементарном акте участвуют только две частицы дисперсной фазы;
· все частицы имеют одинаковый размер и обладают одинаковой подвижностью, форму частиц считают сферической.
Смолуховский предположил, что в начальной стадии процесс коагуляции протекает как бимолекулярная реакция и описывается уравнением реакции второго порядка:
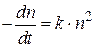 . (5.1)
. (5.1)
После интегрирования уравнения (5.1) получаем выражения для расчета константы скорости процесса коагуляции, числа частиц и времени половинной коагуляции в любой момент времени:
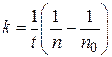 ; (5.2)
; (5.2)
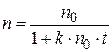 ; (5.3)
; (5.3)
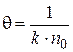 , (5.4)
, (5.4)
где n 0 – общее число частиц в единице объема золя до коагуляции;
n – число частиц к моменту времени t; k – константа скорости процесса коагуляции; θ – временя половинной коагуляции, время, в течение которого начальная концентрация частиц уменьшится в два раза 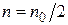 .
.
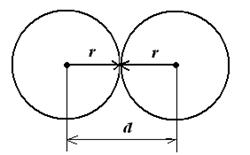 Рис. 5.2. Взаимное притяжение частиц при d = 2r Рис. 5.2. Взаимное притяжение частиц при d = 2r | Теория быстрой коагуляции Смолуховского позволяет оценить критическое расстояние d, при котором становится возможным слипание двух дисперсных частиц. Рассмотрим самый простой случай – обе частицы представляют собой сферы одинакового радиуса r (рис. 5.2). |
Согласно теории Смолуховского, константа скорости коагуляции k зависит от интенсивности броуновского движения и определяется коэффициентом диффузии D и расстоянием между центрами дисперсных частиц d, на котором действуют силы притяжения между частицами:
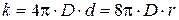 . (5.5)
. (5.5)
Подставим в уравнение (5.5) вместо коэффициента диффузии его значение из уравнения Эйнштейна:
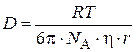 , (5.6)
, (5.6)
где η– вязкость дисперсионной среды; r – радиус коагулирующих частиц; 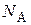 – число Авогадро; R – универсальная газовая постоянная;
– число Авогадро; R – универсальная газовая постоянная;
Т – температура.
Константа скорости быстрой коагуляции k является постоянной для данной коллоидной системы и вычисляется по уравнению:
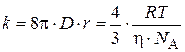 . (5.7)
. (5.7)
Тогда для времени половинной коагуляции уравнение примет вид:
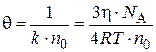 . (5.8)
. (5.8)
Из (5.7) следует, что величина константы скорости коагуляции не зависит от начальной концентрации золя и от размера частиц дисперсной фазы, k – постоянная только для данного золя, а зависит от температуры и вязкости дисперсионной среды. Вязкость жидкостей, как правило, уменьшается с повышением температуры, следовательно, константа скорости процесса коагуляции сильно зависит от температуры.
Время половинной коагуляции уменьшается с ростом концентрации дисперсной фазы. Таким образом, агрегативная устойчивость дисперсных систем увеличивается с возрастанием вязкости дисперсионной среды, понижением температуры и концентрации дисперсной фазы.
Если величина k, вычисленная из экспериментальных данных, не совпадает с величиной, полученной по уравнению (5.7) (k эксп <k теор), то в системе протекает не быстрая, а медленная коагуляция.
Смолуховский предложил формулы, позволяющие определить, сколько частиц того или иного порядка (первичных, вторичных и т.д.) имеется в золе в момент времени t:
· для общего числа частиц:
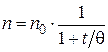 ; (5.9)
; (5.9)
· для первичных частиц:
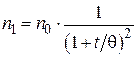 ; (5.10)
; (5.10)
· для вторичных частиц:
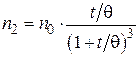 . (5.11)
. (5.11)
· для частиц т- го порядка:
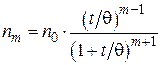 . (5.12)
. (5.12)
Графическая зависимость изменения числа частиц от времени коагуляции изображена на рис. 5.3.
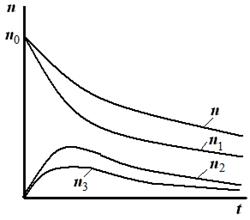 Рис. 5.3. Изменение числа частиц во времени при быстрой коагуляции Рис. 5.3. Изменение числа частиц во времени при быстрой коагуляции | Из рис. 5.3 видно, что функции распределения общего числа частиц n и частиц первого порядка n 1 – монотонно убывающие, причем число первичных частиц n 1 уменьшается быстрее, чем общее число частиц n, т.к. начинают появляться двойные, тройные и т.д. частицы. Для частиц высших порядков кривые проходят через максимум, высота которого уменьшается по мере увеличения размера частиц. |
Согласно теории Смолуховского, время половинной коагуляции не зависит от времени коагуляции. Чтобы проверить применимость теории по экспериментальным данным вычисляют θ для нескольких значений t по уравнению:

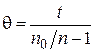 . (5.13)
. (5.13)
Если величина θ остается постоянной при различных значениях времени коагуляции, то в системе протекает быстрая коагуляция, для которой применима теория Смолуховского. Представления Смолуховского объясняют коагуляцию монодисперсных золей.
Представления Смолуховского объясняют коагуляцию монодисперсных золей. Теория коагуляции полидисперсных золей была разработана Мюллером. Мюллер показал, что частицы различных размеров коагулируются быстрее, чем частицы одинаковых размеров. При этом «большие» частицы играют роль центров коагуляции – коагуляция преимущественно происходит при столкновении малых частиц с большими. Таким образом, чем больше больших частиц, тем выше скорость коагуляции. Теория Мюллера объясняет автокаталитический характер коагуляции, скорость которой может постепенно возрастать со временем. Мюллер показал, что скорость коагуляции возрастает, если частицы имеют удлиненную форму. В этом случае на поступательное движение частиц дисперсной фазы накладывается еще и вращательное движение, увеличивающее вероятность столкновения частиц.
Пример 5.1. Во сколько раз уменьшится начальное число частиц n 0 дыма мартеновских печей через 1, 10 и 100 с после начала коагуляции? Средний радиус частиц r = 2·10–8 м, массовая концентрация частиц в 1 м3 составляет 1·10–3 кг, плотность частиц ρ = 2,2·103 кг/м3. Константа скорости коагуляции k = 3·10–16 м3/с.
Решение:
1. Найдем объем дисперсной фазы:
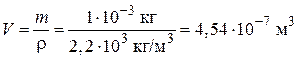 .
.
2. Вычислим объем одной частицы, предполагая, что частицы имеют форму шара:
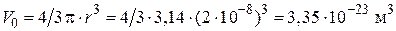 .
.
3. Вычислим начальное число частиц в 1 м3 до коагуляции:
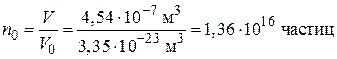 .
.
4. Из уравнения (5.3) следует, что общее число частиц n к моменту времени t равно:
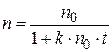 .
.
Отсюда, начальное число частиц 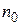 к моменту времени ti уменьшиться в
к моменту времени ti уменьшиться в 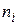 раз:
раз:
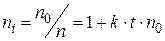 ;
;
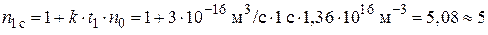 ;
;
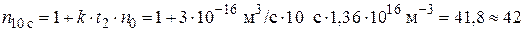 ;
;
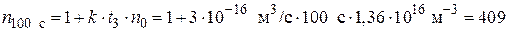 .
.
Начальное число частиц дыма мартеновских печей через 1 с уменьшится в 5 раз, через 10 с – в 42 раза, через 100 с – в 409 раз.
Пример 5.2. Начальное число частиц золя 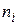 составляет 5·108 частиц. Время половинной коагуляции θ= 335 с. Рассчитайте общее число частиц n через: 100; 200; 250; 350 и 400 с после начала коагуляции. Постройте график изменения общего числа частиц от времени коагуляции в координатах n = f (t).
составляет 5·108 частиц. Время половинной коагуляции θ= 335 с. Рассчитайте общее число частиц n через: 100; 200; 250; 350 и 400 с после начала коагуляции. Постройте график изменения общего числа частиц от времени коагуляции в координатах n = f (t).
Решение. Рассчитываем общее число частиц по уравнению (5.9):
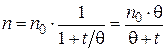 ;
;
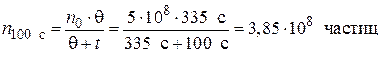 ;
;
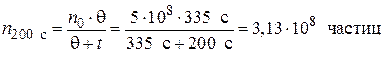 ;
;
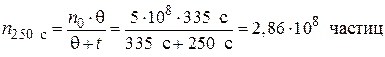 ;
;
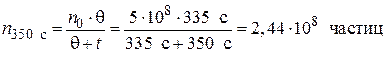 ;
;
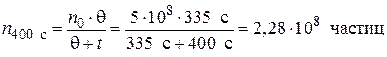
Построим график зависимости общего числа частиц от времени коагуляции в координатах n = f (t).
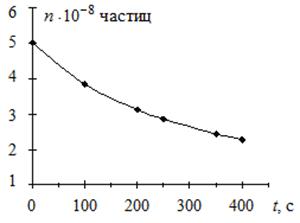
Рис. 5.4. Зависимость общего числа частиц
от времени
 2015-06-05
2015-06-05 12846
12846
