1. Все без исключения сильные электролиты при определенной концентрации могут вызвать коагуляцию коллоидного раствора.
2. Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы. Этот ион электролита называют ионом-коагулятором.
3. Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции.
Порог коагуляции (γ, С кр) – некоторая минимальная (критическая) концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя:
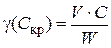 , (5.14)
, (5.14)
где 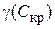 – порог коагуляции (критическая концентрация электролита, вызывающая коагуляцию золя), моль/л; V – объем электролита, вызывающего коагуляцию, мл; C – концентрация электролита, моль/л; W – объем золя, мл.
– порог коагуляции (критическая концентрация электролита, вызывающая коагуляцию золя), моль/л; V – объем электролита, вызывающего коагуляцию, мл; C – концентрация электролита, моль/л; W – объем золя, мл.
Коагулирующая способность (сила) электролита (P) – величина, обратно пропорциональная порогу коагуляции:
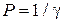 . (5.15)
. (5.15)
4. Влияние заряда (валентности) иона коагулятора (правило Шульце – Гарди). Коагулирующая способность электролита возрастает с увеличением валентности иона-коагулятора.
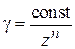 , (5.16)
, (5.16)
где 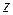 – валентность (заряд) иона-коагулятора, n = 2 6
– валентность (заряд) иона-коагулятора, n = 2 6
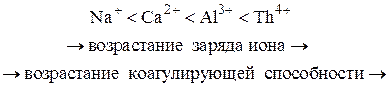
5. Коагулирующая сила ионов-коагуляторов одной и той же валентности возрастает с увеличением радиуса иона-коагулятора (лиотропные ряды).
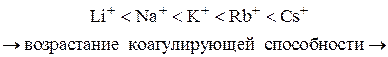
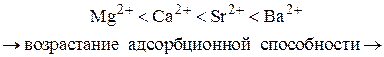
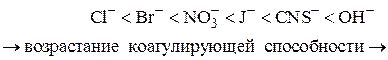
Пример 5.3. Золь гидроксида цинка получен путем сливания растворов ZnCl2 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:
| Электролит | Na2SO4 | Mg(NO3)2 | Na3PO4 | NaCl |
| γ, моль/л | 0,05 | 3,0 | 0,004 | 3,0 |
Решение. Определим знак заряда частиц золя. Так как катионы всех электролитов-коагуляторов одновалентны, а их пороги коагуляции разные, что не соответствует правилу Шульце – Гарди, следовательно, коагуляцию золя вызывают не катионы, а анионы электролитов. В данном случае получается: чем выше заряд аниона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы положительный. Следовательно, потенциалопределяющие ионы – Zn2+, противоионы – Сl–.
Запишем строение мицеллы:
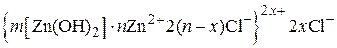 .
.
Пример 5.4. Золь иодида серебра получен сливанием растворов KI и AgNO3. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:
| Электролит | KCl | KNO3 | Ba(NO3)2 | La(NO3)3 |
| γ, моль/л | 5,2 | 5,1 | 0,08 | 0,007 |
Решение. Определим знак заряда частиц золя. Так как анионы всех электролитов-коагуляторов одновалентны, а их пороги коагуляции разные, что не соответствует правилу Шульце – Гарди, следовательно, коагуляцию золя вызывают не анионы, а катионы электролитов. В данном случае получается: чем выше заряд катиона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы отрицательный. Следовательно, потенциалопределяющие ионы – I–, противоионы – K+.
Запишем строение мицеллы:
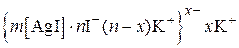 .
.
Пример 5.5. Золь гидроксида алюминия получен путем сливания растворов AlCl3 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции электролитов следующие:
| Электролит | Na2SO4 | Mg(NO3)2 | Na3PO4 | NaCl |
| γ, моль/л | 0,011 | 0,70 | 0,001 | 0,70 |
Решение. Определим знак заряда частиц золя. У Mg(NO3)2 и NaCl одинаковые пороги коагуляции, одинаковый заряд аниона, но разный заряд катиона. Следовательно, коагуляцию золя вызывают анионы электролитов.
В данном случае получается: чем выше заряд аниона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы положительный. Следовательно, потенциалопределяющие ионы – Al3+, противоионы – Сl–.
Запишем строение мицеллы:
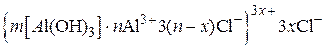 .
.
5.3. Теория устойчивости
лиофобных дисперсных систем ДЛФО
В процессе развития коллоидной химии возникало много теорий, авторы которых пытались связать устойчивость гидрофобных золей, в частности коагулирующее действие электролитов, с теми или иными параметрами системы и явлениями, возникающими при взаимодействии дисперсной фазы с дисперсионной средой.
Каждая из теорий (химическая, адсорбционная, электростатическая и др.) объясняла только ряд факторов, но оказывалась бессильной перед множеством других факторов, т.к. все эти теории носили, в основном, односторонний характер и связывали сложный процесс коагуляции с каким-либо одним параметром системы.
Современная физическая теория устойчивости была предложена Б.В. Дерягиным, совместно с Л.Д. Ландау (1937–1941 гг.). Несколько позже теоретическая разработка, почти аналогичная и приводящая к тем же результатам, была осуществлена независимым путем Е. Фервеем и Дж. Овербеком. Поэтому, современная теория устойчивости обозначается в литературе как теория ДЛФО (DLFO).
Современная теория устойчивости ДЛФО рассматривает процесс коагуляции как результат совместного действия Ван-дер-Ваальсовых сил притяжения и электростатических сил отталкивания между частицами. В зависимости от баланса этих сил в тонкой прослойке жидкости между сближающимися частицами возникает «расклинивающее давление».
 2015-06-05
2015-06-05 15735
15735
