1. Вычислить а) температуру кипения, б) температуру замерзания водного раствора, содержащего 0,1 моль сахарозы (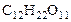 ) в 500 г раствора.
) в 500 г раствора.
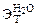 =0,52 кг·К/моль,
=0,52 кг·К/моль, 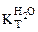 = 1,86 кг·К/моль
= 1,86 кг·К/моль

| РЕШЕНИЕ: а) Температура кипения водного раствора сахарозы рассчитывается по уравнению: tкип р-ра = 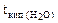 + + 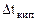 = = 1000С + = = 1000С + 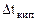 , ∆tкип = , ∆tкип = 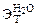 ·cm ( ·cm (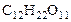 ), cm( ), cm(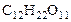 ) – моляльность сахарозы в растворе, моль/кг. ) – моляльность сахарозы в растворе, моль/кг. |
cm(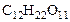 ) =
) = 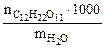 , (6.1)
, (6.1)
где 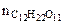 - количество растворенной сахарозы, моль.
- количество растворенной сахарозы, моль.
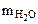 =
= 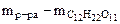 , г
, г
cm(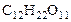 ) =
) = 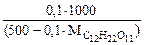 =
=
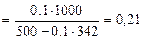 моль/кг,
моль/кг,
М 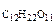 = 342 г/моль
= 342 г/моль
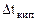 = 0,52∙0,21 = 0,110С
= 0,52∙0,21 = 0,110С
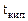
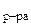 = 1000С + 0,110С = 100,110С
= 1000С + 0,110С = 100,110С
б) Температура замерзания водного раствора рассчитывается по уравнению:
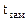
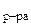 =
= 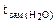 -
- 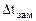 = 00С -
= 00С - 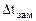 ,
,
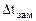 =
= 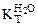 ·cm (
·cm (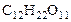 ),
),
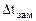 = 1,86∙0,21 = 0,390С
= 1,86∙0,21 = 0,390С
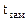
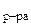 = 00С - 0,390С = -0,390С
= 00С - 0,390С = -0,390С
Ответ: 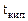
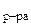 = 100,110С
= 100,110С 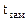
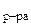 = - 0,390С
= - 0,390С
2. В 100 г воды содержится 2,3 г неэлектролита. Раствор обладает при 250С осмотическим давлением, равным 618,5 кПа. Определить молярную массу неэлектролита. Плотность раствора принять равной 1,05 г/см3.
 | РЕШЕНИЕ π = 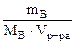 ∙R∙T, кПа (6.2) где mВ – масса растворенного неэлектролита, г МВ – молярная масса растворенного неэлектролита, г/моль. R = 8,314 л∙кПа/(моль∙К) Т = 273 + to Vр-ра = mр-ра/ρр-ра = (mB + m ∙R∙T, кПа (6.2) где mВ – масса растворенного неэлектролита, г МВ – молярная масса растворенного неэлектролита, г/моль. R = 8,314 л∙кПа/(моль∙К) Т = 273 + to Vр-ра = mр-ра/ρр-ра = (mB + m 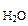 )/ρр-ра = = )/ρр-ра = = 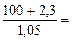 97,43 см3 = 0,097 л 97,43 см3 = 0,097 л |
МВ = 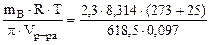 = 94,98 г/моль
= 94,98 г/моль
Ответ: молярная масса растворенного вещества равна
94,98 г/моль.
3. Определить массу воды, которую необходимо прибавить к 10 г карбамида CO(NH2)2, чтобы давление пара над полученным раствором при температуре 298К составило 3,066 кПа. Давление пара над водой при этой температуре равно 3,166 кПа.
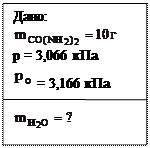 | Решение Давление насыщенного пара воды над раствором электролита равно: 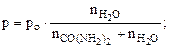 (6.3) (6.3) |
Откуда
где 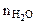 - количество воды, моль;
- количество воды, моль;
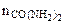 - количество карбамида, моль.
- количество карбамида, моль.
Откуда 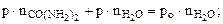
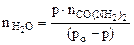 =
= 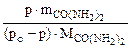 =
=
= 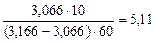 моль
моль
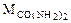 = 12 + 16 + 2(14 + 2) = 60 г/моль.
= 12 + 16 + 2(14 + 2) = 60 г/моль.
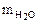 =
= 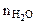 · М
· М 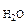 = 5,11 · 18 = 91,98 г
= 5,11 · 18 = 91,98 г
Ответ: 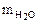 = 91,98 г.
= 91,98 г.
 2015-06-05
2015-06-05 3591
3591

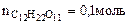 mр-ра = 500 г
mр-ра = 500 г 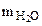 = 100 г π = 618,5 кПа ρр-ра = 1,05г/см3 МВ -?
= 100 г π = 618,5 кПа ρр-ра = 1,05г/см3 МВ -?