Дано: c 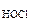 = 0,05 М = 0,05 М |
| pH -? |
РЕШЕНИЕ:
HOCl <=> H+ + OCl- (7.3)
HOCl - слабый электролит.
рН = - lg [H+]; [H+] = cНOСl·α·n 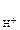 ,
,
n 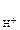 - число Н+ образовавшихся при диссоциации одной молекулы HOCl, n
- число Н+ образовавшихся при диссоциации одной молекулы HOCl, n 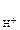 = 1.
= 1.
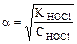
КHOCl - константа диссоциации HOCl:
К 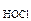 =5,0·10-8, (табл.),
=5,0·10-8, (табл.),
тогда 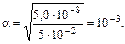
c 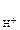 = cНOСl·α·n
= cНOСl·α·n 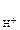 = 5·10-2·10-3·1 = 5,0·10-5 моль/л,
= 5·10-2·10-3·1 = 5,0·10-5 моль/л,
тогда рН = - lg5,0·10-5 = 4,3.
Ответ: рН 0,05 М HOCl равно 4,3.
3. Определить произведение растворимости MgF2, если его растворимость в воде при 250С равна 1,17·10-3 моль/л.
Дано: c 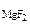 = 1,17·10-3 моль/л = 1,17·10-3 моль/л |
ПР 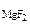 -? -? |
РЕШЕНИЕ:
Равновесие между осадком малорастворимого электролита и его насыщенным раствором выражается уравнением:
MgF2(к) <=> Mg2+ (р) + 2F-(р) (7.4)
ПР 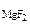 = [Mg2+ ]·[F-]2,
= [Mg2+ ]·[F-]2,
[Mg2+ ] = c 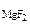 ·α·n
·α·n 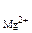 , [F-] = c
, [F-] = c 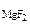 ·α·n
·α·n 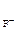 .
.
MgF2 - сильный электролит, α = 1.
n 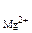 = 1, n
= 1, n 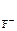 = 2 (из уравнения 7.4)
= 2 (из уравнения 7.4)
[Mg2+ ] = 1,17·10-3·1·1 = 1,17·10-3 моль/л,
[F-] = 1,17·10-3·1·2 = 2,34·10-3 моль/л.
Тогда ПР 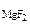 = 1,17·10-3·(2,34 10-3)2 = 6,41·10-9.
= 1,17·10-3·(2,34 10-3)2 = 6,41·10-9.
Ответ: ПР 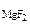 = 6,41·10-9
= 6,41·10-9
 2015-06-05
2015-06-05 2364
2364








