1. Вычислить рН следующих водных растворов:
А) 0,02 М HCl; б) 0,2 М KOH
| Дано: cHCl = 0,02 М cKOH = 0,2 М |
| pH -? |
РЕШЕНИЕ:
а) HCl = H+ + Cl- (7.1)
рН = - lg c 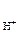
c 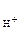 = cНСl·α·n
= cНСl·α·n 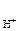 ,
,
HCl - сильный электролит, α = 1;
n 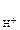 - число Н+, образовавшихся при диссоциации одной молекулы НСl;
- число Н+, образовавшихся при диссоциации одной молекулы НСl;
n 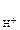 = 1, тогда c
= 1, тогда c 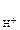 = c
= c 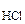 = 0,02 моль/л = 2·10-2 моль/л.
= 0,02 моль/л = 2·10-2 моль/л.
рН = - lg 2·10-2 = 1,7.
б) KOH = К+ + ОН-, (7.2)
рН = 14 - рОН; рОН = - lg c 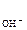 ;
;
c 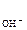 = c
= c 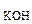 ·α·n
·α·n 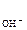 ,
,
КОН - сильный электролит, α = 1;
n 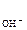 - число ОН-, образовавшихся при диссоциации одной молекулы КОН, n
- число ОН-, образовавшихся при диссоциации одной молекулы КОН, n 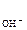 = 1, тогда
= 1, тогда
c 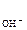 = cKOH = 2·10-1 моль/л, рОН = - lg (2·10-1) = 0,7
= cKOH = 2·10-1 моль/л, рОН = - lg (2·10-1) = 0,7
рН = 14 - 0,7 = 13,3.
Ответ: рН 0,02 М HCl равно 1,7;
рН 0,2 М КОН равно 13,3.
 2015-06-05
2015-06-05 620
620








