Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.
Дано: Электролит: K2SO4 τ = 4 ч Т = 298 К I = 2 A Р = 99 кПа Анод инертный  1. Схема электролиза-? 2. 1. Схема электролиза-? 2. 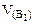 (катод) -? 3. (катод) -? 3. 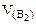 (анод) -? (анод) -? | РЕШЕНИЕ K2SO4 = 2K+ + 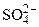 Схема электролиза: K(-) A(+) (инертный) K+ Схема электролиза: K(-) A(+) (инертный) K+ 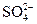 2H2O + 2ē = 2H2O - 4ē = = H2 + 2OH- = О2 + 4H+ На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): 2H2O + 2ē = 2H2O - 4ē = = H2 + 2OH- = О2 + 4H+ На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): |
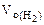 =
= 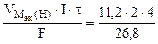 = 3,34 л.
= 3,34 л.
где 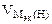 = 11,2 л/моль.
= 11,2 л/моль.
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
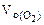 =
= 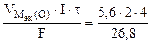 = 1,67 л,
= 1,67 л,
где 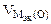 = 5,6 л/моль, т.е.
= 5,6 л/моль, т.е. 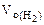 = 2
= 2 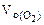
Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:
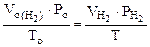 ,
,
откуда: 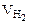 =
= 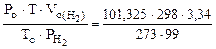 = 3,73 л
= 3,73 л
Объем кислорода при заданных условиях:
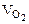 = 1/2
= 1/2 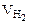 = 1,865 л.
= 1,865 л.
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см2, необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см3.
  Дано: Электролит: CuCl2 S = 100 см2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см3 Дано: Электролит: CuCl2 S = 100 см2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см3  Анод медный Схема электролиза-? Анод медный Схема электролиза-?  Время электролиза, τ -? Время электролиза, τ -? |  РЕШЕНИЕ CuCl2 = Cu2+ + 2Cl- Схема электролиза: K(-) A(+) (Cu) Cu2+ + 2ē = Cu Cl- H2O H2O Cu – 2ē = Cu2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ= РЕШЕНИЕ CuCl2 = Cu2+ + 2Cl- Схема электролиза: K(-) A(+) (Cu) Cu2+ + 2ē = Cu Cl- H2O H2O Cu – 2ē = Cu2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ= 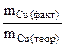 ; mCu(факт) = mCu(теор)·ВТ ; mCu(факт) = mCu(теор)·ВТ |
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) = 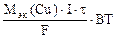 .
.
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см2, h – см, ρ – г/см3.
S∙h∙ρCu = 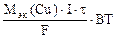 ,
,
откуда
τ = 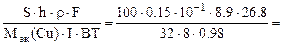 1,43 часа,
1,43 часа,
где Mэк(Cu) = 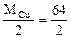 = 32 г/моль
= 32 г/моль
F = 26,8 – А∙ч/моль,
10-1 – коэффициент пересчета мм в см.
Ответ: 1,43 часа.
3.Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
   Дано: Электролит: AgNO3 I = 4 A Дано: Электролит: AgNO3 I = 4 A 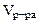 = 75 см3 τ = 25 мин Анод инертный = 75 см3 τ = 25 мин Анод инертный  Схема электролиза-? Схема электролиза-? 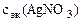 -? -? | РЕШЕНИЕ AgNO3 = Ag+ + 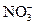 Схема электролиза: K(-) A(+) инертный Ag+ + ē= Ag Схема электролиза: K(-) A(+) инертный Ag+ + ē= Ag 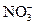 H2O 2H2O - 4ē = О2 + 4H+ На катоде выделяется Ag, на аноде выделяется О2. H2O 2H2O - 4ē = О2 + 4H+ На катоде выделяется Ag, на аноде выделяется О2. |

Молярная концентрация эквивалента раствора AgNO3:
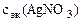 =
= 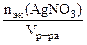
По закону эквивалентов: nэк(AgNO3) = nэк(Ag),
nэк(Ag) = 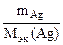 ,
,
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg = 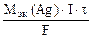 , откуда
, откуда
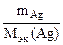 =
= 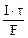 = nэк(Ag) = nэк(AgNO3)
= nэк(Ag) = nэк(AgNO3)
Молярная концентрация эквивалента раствора AgNO3:
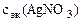 =
= 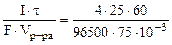 = 0,83 моль/л.
= 0,83 моль/л.
где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10-3 – коэффициент пересчета см3 в л.
Ответ: 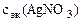 = 0,83 моль/л.
= 0,83 моль/л.
 2015-06-05
2015-06-05 2162
2162