1. Используя справочные данные по 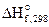 и
и 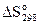 , определить температурную границу возможного технического использования карботермического процесса: PbO(к) + C(к) < = > Pb(к) + CO(г)
, определить температурную границу возможного технического использования карботермического процесса: PbO(к) + C(к) < = > Pb(к) + CO(г)
Записать выражение для константы равновесия Кр
| Дано: Уравнение реакции | РЕШЕНИЕ: Приведенный процесс будет возможен, когда равновесное давление оксида углерода (II) будет равно наружному давлению или превышать его, т.е. РСО = 1 |
| Т -? |
При равновесии 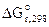 = 0, тогда КР = РСО = 1, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения:
= 0, тогда КР = РСО = 1, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения:
- 2,303RT lgKP = 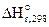 – Т·
– Т· 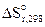
Так как lgKP = lg1 = 0, то 0 = 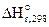 ·1000 – Т ·
·1000 – Т · 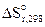
Откуда 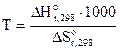
где 1000 – коэффициент перевода кДж в Дж
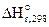 и
и 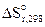 определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение (12.1):
определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение (12.1):
PbO(к) + C(к) < = > Pb(к) + CO(г) (12.1)
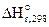 -219,3 0 0 -110,5
-219,3 0 0 -110,5
кДж/моль
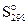 66,1 5,7 64,9 197,5
66,1 5,7 64,9 197,5
Дж/мольК
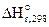 = -110,5 – (-219,3) = 108,8 кДж
= -110,5 – (-219,3) = 108,8 кДж
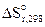 = 197,5 + 64,9 – 5,7 – 66,1 = 190,6 Дж/К
= 197,5 + 64,9 – 5,7 – 66,1 = 190,6 Дж/К
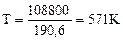
Ответ: процесс возможен при нагревании начиная с Т = 571К
При взаимодействии 7,27 г смеси, состоящей из оксида цинка с цинком, с водным раствором щелочи выделилось 1,12 л водорода (н.у.). Написать уравнения протекающих процессов. Вычислить массовую долю оксида цинка в смеси.
Дано: Смесь Zn и ZnO 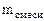 = 7,27 г Vо ( = 7,27 г Vо ( 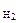 ) = 1,12 л ) = 1,12 л  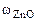 -? -? | РЕШЕНИЕ: 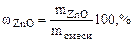 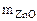 = = 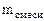 - - 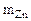 ZnО + H2О + 2NaOH = Na2[Zn(OH)4] (12.2) Zn о+2 ZnО + H2О + 2NaOH = Na2[Zn(OH)4] (12.2) Zn о+2 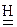 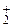 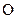 +2NaOH=Na2[ Zn +2(OH)4] + +2NaOH=Na2[ Zn +2(OH)4] + 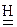 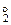 (12.3) (12.3) |

 НОК ДМ
НОК ДМ
Znо – 2e = Zn+2 1
H+ + e = Hо 2
 |
Zn + 2H+ = Zn+2 + 2Hо
Поскольку водород выделяется только при взаимодействии цинка с водным раствором щелочи, то массу цинка определяем из уравнения реакции (12.3):
Составляем пропорцию:
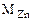 вытеснит 22,4 л Н2
вытеснит 22,4 л Н2
 65,4 г Zn 22,4 л Н2
65,4 г Zn 22,4 л Н2

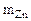 1,12 л Н2
1,12 л Н2
где 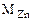 = 65,4 г/моль
= 65,4 г/моль
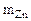 =
= 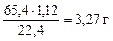
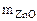 =
= 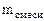 -
- 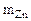 = 7,27 – 3,27 = 4 г
= 7,27 – 3,27 = 4 г
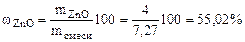
Ответ: 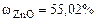 .
.
 2015-06-05
2015-06-05 4672
4672








