В водном растворе соль CuCl2 диссоциирует: CuCl2 Á Сu2+ + 2Cl–.
К катоду подходят катионы Сu2+ и Н2О; к аноду – ионы Cl– и Н2О. Медный анод – растворимый, он принимает участие в электродной реакции. Потенциал φ0Сu/Cu2+ = 0,34 В, и на катоде, в соответствии с вышеприведенной схемой, будет восстанавливаться Сu2+. В анодном процессе участвует металл анода (Cu-растворимый анод):
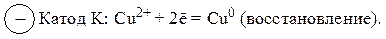
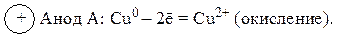
В результате электролиза медь переносится с анода на катод, а соль оказывается не затронутой этим процессом и обеспечивает лишь электропроводность.
Количественная характеристика процессов электролиза даётся законами Фарадея. Им можно дать следующую общую формулировку:
масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Объединенный закон Фарадея выражается следующим уравнением:
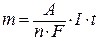 ,
,
где А – атомная масса вещества простого вещества, выделяющегося на электроде;
n – заряд иона или число электронов, принимающих участие в процессе электролиза;
I – сила тока в амперах, А;
t – время пропускания тока в секундах, с;
F – число Фарадея (F = 96 500 Кл/моль).
Эквивалентная масса вещества 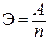 .
.
Поскольку обычно имеются конкурирующие процессы, законы Фарадея нуждаются в поправках.
Отношение массы фактически выделившегося на электроде вещества m пр. к массе вещества, которая должна была выделиться в соответствии с законом Фарадея, называется выходом по току h:
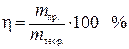 .
.
Пример 3. При прохождении электрического тока силой 1 А через раствор FeCl2 (электроды инертные) в течение 1 ч выделилось 0,90 г железа. Определите выход по току. На какие процессы расходуется остальной ток?
 2015-02-27
2015-02-27 1117
1117
