CuSO4(р) + Fe(к) < = > FeSO4(р) + Cu(к)
Записать выражение для константы равновесия
Дано: Уравнение реакции  Кс -? Кс -? | РЕШЕНИЕ Записываем реакцию в ионно- молекулярном виде: |
Feo(к) + Cu2+(р) + SO 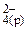 <=> Fe2+(р) + SO
<=> Fe2+(р) + SO 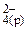 + Cuo(к) – полное ионно-молекулярное уравнение
+ Cuo(к) – полное ионно-молекулярное уравнение
Cu2+(р) + Feo(к) < = > Fe2+(р) + Cuo(к) – сокращенное ионно-молекулярное уравнение
НОК ДМ

 окис-ль Сu2+ + 2ē = Cu 1
окис-ль Сu2+ + 2ē = Cu 1 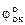 = 0,34В (табл. 11.1)
= 0,34В (табл. 11.1)
 восст-ль Feo - 2ē = Fe2+ 1
восст-ль Feo - 2ē = Fe2+ 1 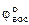 = -0,44В (табл. 11.1)
= -0,44В (табл. 11.1)
Cu2+ + Feo = Cuo + Fe2+ - стандартное напряжение этой реакции
εo = 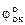 -
- 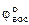 ; εo = 0,34 - (-0,44) = 0,78В
; εo = 0,34 - (-0,44) = 0,78В
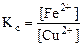
Так как приведенная реакция является окислительно-восстановительной, то:
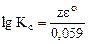 ;
; 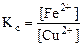 =
= 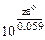 , где z - НОК
, где z - НОК
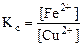 =
= 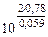 = 1026
= 1026
Ответ: Кс = 1026. Высокое значение Кс свидетельствует о практически полном смещении равновесия вправо.
 2015-06-05
2015-06-05 7322
7322








