- 1М раствор сульфата меди, то по потенциалу медного электрода
Е(Cu/Сu 2+) = +0,337 в и цинкового электрода Е(Zn/Zn 2+ +) = - 0.762 в
можно найти ЭДС этого элемента:
Е(Cu/Сu 2+) + Е(Zn/Zn 2+ +) = +0,337 -(-0.762)= 1,099 в.
На границе цинка и раствора сульфата цинка идёт процесс Zn= Zn 2+ +2е-. Цинковый электрод получает отрицательный заряд и электроны по внешней цепи переходят к меди. На границе медного электрода и раствора сульфата меди протекает реакция Сu 2+ +2е- = Сu, т. е. на медном электроде выделяется медь. Одновременно по внутренней цепи от меди к цинку перемещаются отрицательные ионы SO42-, которые вместе с перешедшими в раствор ионами цинка образуют раствор сульфата цинка. Суммарное уравнение процессов на электродах: Zn + Сu 2+ = Zn 2+ + Сu
Электрическая энергия элемента Даниэля — Якоби образуется за счёт химической энергии указанной реакции. В отличие от элемента Вольта, элемент Даниэля - Якоби является обратимым, т. е., пропуская ток от внешнего источника в обратном направлении, можно привести элемент в исходное состояние.
7. Анодное окисление и катодное восстановление. Явления перенапряжения.
Одностороннее движение ионов при прохождении электрического тока (подаваемого от внешнего источника) через электролит, сопровождающееся разрядом положительных ионов на катоде (процесс восстановления) и отрицательных ионов на аноде (процесс окисления), называется электролизом. В результате электролиза на электродах выделяются продукты окисления и восстановления, которые могут вступать в реакции с окружающей средой (вторичные процессы при электролизе).
Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, к положительному полюсу — анод и погружают их в раствор или расплав электролита. В большинстве случаев электроды бывают металлические, но применяются и неметаллические, проводящие ток электроды, например, графитовые
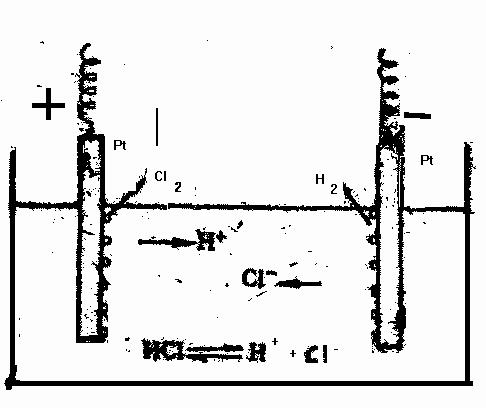
Рис. 6. Схема электролиза раствора НСl
Металлические аноды могут быть растворимыми (при электролизе они посылают в раствор свои ионы) и нерастворимыми (служат только для передачи электронов)
Рассмотрим схему электролиза раствора хлористого водорода с платиновыми нерастворимыми электродами (рис. 8).
На катоде идет процесс восстановления:
2Н+ +2е-=Н2;
образующийся водород выделяется в виде газа.
На аноде идет процесс окисления:
2Сl- = С12 + 2e-
выделяется газообразный хлор.
Катодное перенапряжение – это дополнительное напряжение, прикладываемое к катоду, при этом потенциал анода смещается далее в отрицательную сторону, а анодное – к аноду, при этом потенциал анода смещается далее в положительную сторону. Потенциал электрода, через который пропускается ток, Еi отличается от потенциала того же электрода без тока Е0. В общем случае, когда на электроде могут протекать несколько реакций, например на катоде с водным раствором электролита может протекать разряд ионов металла и разряд ионов водорода, разность потенциалов Еi – Е0 называют поляризацией. Перенапряжение затрудняет протекание электродного процесса и вызвано
Если же при электролизе на электроде протекает только одна реакция, например разряд ионов металла на катоде то величина Еi – Е0 равна перенапряжению η и в этом случае величина поляризации и перенапряжения совпадают. Перенапряжение на катоде, например, обусловлено тем, что переход гидратированного иона из водного раствора на катод связан с затратами энергии, (отсюда –перенапряжение, то есть, смещение напряжения на катоде в отрицательную сторону) на перенос ионов металла из раствора к поверхности катода; на разряд катионов с протеканием тех или иных химических процессов нарпример.ь дегидратации ионов. на внедрение образовавшихся атомов металла в кристаллическую решётку катодного отложения.
Перенапряжение, как катодное, так и анодное, так и анодное, зависит от материала электродов, состояния их поверхности, от природы разряжающихся на электроде ионов и на единицу площади поверхности электрода (плотность тока) Особенно большое значение имеет катодное перенапряжение выделения водорода. на платине оно близко к нулю. в то время как на других электродах имеет значительную величину. Напряжение разложения – общее напряжение, прилагаемое к электролитической ячейке, напряжение внешнего источника электричества, при котором начинается электролиз.
 2015-05-20
2015-05-20 1608
1608
