Коферментами називають низькомолекулярні органічні сполуки небілкової природи, що володіють здатністю оборотно зв’язуватися з ферментним білком. Їх можна відділити від апофермента діалізом, дією кислот або лугів, пропусканням через колонку з сефадексом. Утворення молекули ферменту з апо- і коферментів відбувається за рахунок слабих електростатичних або вандерваальсових сил. При цьому змінюється вторинна і третинна структури молекули, після чого фермент-білок стає більш стійким до денатуруючих чинників, ніж апофермент. Коферменти в активному центрі виконують роль переносника різних функціональних груп, протонів і електронів. Окремі коферменти беруть участь в активації молекул субстратів. Коферменти, відщеплюючись від апофермента, здійснюють транспортування цих речовин між окремими ферментами ферментативного ланцюга, перерозподіл їх між органоїдами і гіалоплазмою. В ході каталітичного акту коферменти зазвичай не зазнають глибоких хімічних змін і можуть багато разів (у складі одного або декількох ферментів) брати участь у ферментативних реакціях.
Більшість коферментів є похідними вітамінів. Хімічна природа кофермента значною мірою визначає тип і механізми реакцій які вони каталізують. Недостатня кількість вітаміну в раціоні викликає гальмування тих реакцій обміну речовин, в яких бере участь фермент.
Найбільш поширені такі коферменти.
Нікотінамідаденіндинуклеотид (НАД). Цей кофермент відноситься до універсальних по розповсюдженню і біологічній ролі. Містить каталітично активне угрупування – амід нікотинової кислоти. Структура НАД була вивчена О. Варбургом і X. Ейлером у 1936 р. НАД є складовою частиною понад 40 різних дегідрогеназ:
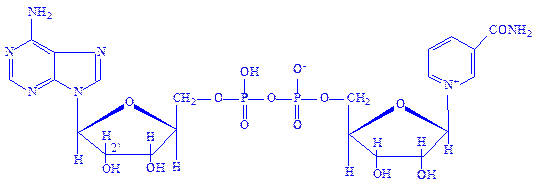
Сировиною для отримання НАД зазвичай служать дріжджі.
Нікотинамідаденіндинуклеотид фосфат (НАДФ). Цей кофермент відрізняється від НАД наявністю третього залишку фосфорної кислоти в положенні 2¢ рибози аденілової частини молекули.
НАДФ входить до складу меншого числа ферментів, ніж НАД. НАД в тканинах в 5 – 10 разів більше, ніж НАДФ. НАД і НАДФ є першою ланкою в ланцюзі проміжних переносників водню при біологічному окисленні.
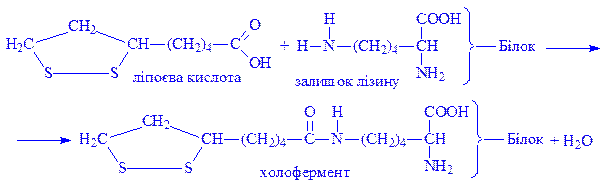
Ліпоєва кислота. Є коферментом багатьох оксидоредуктаз. Зв’язується з апоферментом через карбоксильну групу і аміногрупу залишку лізину:
Коферментна функція ліпоєвої кислоти в активному центрі ферменту обумовлена здатністю легко окислюватися і відновлюватися з утворенням дисульфідних зв’язків або сульфгідрильних груп:
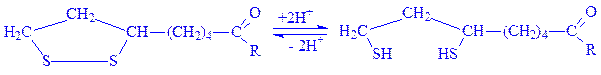
Це і дає можливість ферментам, що містять ліпоєву кислоту, брати участь як в перенесенні ацильних груп, так і реакціях біологічного окислення.
Глутатіон. Один з найпоширеніших природних пептидів. Трипептид глутатіон утворений із залишків трьох амінокислот: глутамінової, цистеїна і гліцина (g-глутамініл-цистеїніл-гліцин):
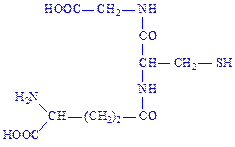
Ним багаті печінка, наднирники та еритроцити (75 – 120 мг%). Значення глутатіона в активному центрі ферментів обумовлено наявністю SH-груп, які легко вступають в реакцію окислення з аналогічними групами субстрата або сусідньої ділянки ферменту, утворюючи дисульфідні зв’язки:
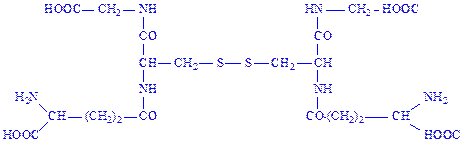
В одних випадках це дає можливість ферменту фіксувати субстрат, в інших – одержувати для окисно-відновних реакцій протони і електрони і т.д. Відновлений глутатіон є коферментом деяких ізомераз, що здійснюють перетворення кетоформ кислот в енольні, циc-ізомерів кислот в транс-ізомери та ін. Деякі ферменти (фосфогліцерин-альдегід-дегідрогеназа) містять глутатіон у вигляді простетичної групи. Глутатіон служить коферментом при дії катепсинів, папаїна та ін. Зараз відомо понад 100 ферментів, що містять тіолові групи. Вважають, що глутатіон входить до складу молекули ферменту у відновленій формі.
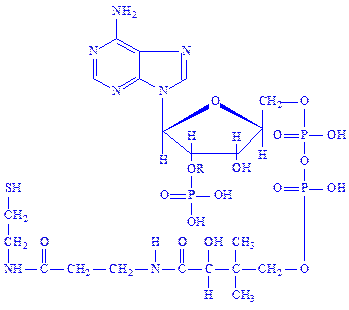
Кофермент А (KoA). KoA – похідне аденілової, фосфорної, пантотенової кислот і b-меркаптоетаноламіна:
Наявність SH-групи у складі молекули кофермента дає йому можливість легко взаємодіяти з жирними кислотами, утворюючи ацилпохідні. KoA іноді називають коферменгом ацилування, або ацетилювання. Відомо понад 70-ти ферментів, у молекулі яких є KoA. Ацетил-КоА бере участь в реакціях перенесення, оксидоредукції, ізомеризації, конденсації і розщепленні ацильних груп.
Убіхінони. Ці коферменти, близькі по будові до вітаміну К, є похідними 5-метил-2,3-диметоксіхінона, в молекулі якого до шостого атома вуглецю приєднується поліізопреновий ланцюг (n = 6– 10):
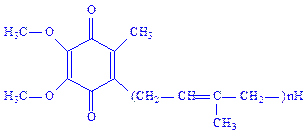
Біологічне значення убіхінонів основане на їх здатності до оборотних окисно-відновних перетворень як проміжних сполук між флавопротеїдами і цитохромами. В ліпідному шарі біологічних мембран їх в 6 – 10 разів більше, ніж цитохромів.
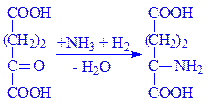
2-Оксоглутарат. Цей метаболіт може виконувати коферментні функції. Складає єдину систему з глутаміновою кислотою в перенесенні аміногрупи трансаміназами:
Нуклеозидфосфати. Ці коферменти беруть участь в реакціях трансфосфорилування і передачі енергії від одного процесу до іншого. Реакції каталізуються кіназами. У ролі коферментів виступають найчастіше такі нуклеозидфосфати: АМФ, АДФ, АТФ, ГМФ, ГДФ, ГТФ, ЦТФ, УМФ, УДФ і інші і, перш за все, АДФ і АТФ.
Вони є, з одного боку, джерелами хімічної енергії, яка необхідна для протікання хімічних реакцій, з іншого – складовими частинами багатьох ферментів і коферментів.
Зокрема, АТФ є коферментом ряду кіназ, які переносять залишок фосфорної кислоти на монози:

АТФ також може бути джерелом пірофосфата для деяких вуглеводів:

АТФ часто виступає в ролі кофермента при перенесенні аденозинмонофосфорного залишку на яку-небудь кислоту, зокрема, на амінокислоту:
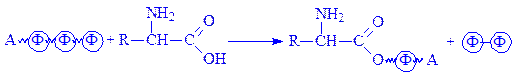
АТФ – джерело аденозильного залишку при активації іперенесенні метильних груп.
Як коферменти часто виступають уридинфосфати і їх похідні. Наприклад, УДФГ використовується при активації, перенесенні і перетворенні цукрів: ізомеризації галактози в глюкозу, синтезі сахарози, лактози, глюкозидів, хітину і т.д.
Коферментні функції виконують і інші нуклеозидфосфати. Зокрема, з участю цитидинфосфатів протікають реакції синтезу окремих видів фосфатидів, особливо лецитину.
Тетрагідрофолієва кислота (ТГФК). Це гомолог фолієвої кислоти, у якої відновлені атоми водню і азоту в положеннях 5, 6, 7 і 8:
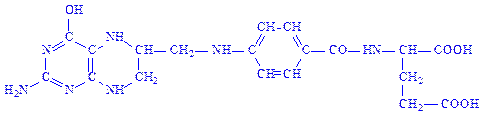
ТГФК є коферментом великої групи трансфераз, що каталізують реакції, пов’язані з перенесенням або активацією одновуглецевих залишків: –СОН, –СН2–ОН, –СН3. З участю ТГФК синтезуються і розщеплюються пуринові основи і деякі амінокислоти: гістидин, гліцин і, особливо, серин.
B12-залежні коферменти. Ці коферменти є похідними вітаміну В12 в молекулі якого ціаниста група заміщена на 5¢-дезоксиаденозин. Кофермент B12 разом з тетрагідрофолієвою кислотою бере участь в перенесенні метильних груп. Під впливом відповідної метилтрансферази від 5-метилтетрагідрофолієвої кислоти метильна група переноситься на кофермент B12 і приєднується до його молекули замість 5¢-дезоксиаденозина. Потім під впливом іншої трансферази ця ж метильна група переноситься на речовину, яка необхідна для синтезу метилвмісної сполуки. Ним може бути гомоцистеїн, з якого утворюється амінокислота метіонін. Після метилування вітамін B12 знову перетворюється в кофермент B12 і вступає в реакцію з новими порціями 5-метилтетрагідрофолієвої кислоти. Крім того, кофермент B12 бере участь в найважливішій для біосинтезу жирних кислот реакції – ізомеризації сукциніл-КоА в метилмалоніл-КоА:
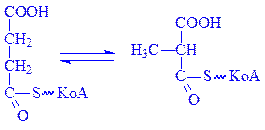
Кофермент B12 бере участь в ізомеризації глутамінової кислоти, перетворенні діолів у альдегіди та в інших важливих реакціях обміну речовин.
Простетичні групи. Багато ферментів у складі своїх молекул містять кофактори, які міцно зв’язані ковалентними зв’язками з апоферментами. Молекули таких ферментів слабо або зовсім не дисоціюють. При утворенні молекули ферменту з апофермента і простетичної групи утворюється стійка вторинна і третинна структура. З кофакторів такого роду найбільший інтерес представляють такі:
Флавіннуклеотиди. Флавіннуклеотиди – це похідні вітаміну B2, або рибофлавіну. В тваринних клітинах зустрічаються в основному флавінмононуклеотиди (ФМН) і флавінаденіндинуклеотиди (ФАД):
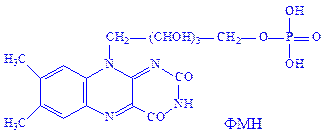
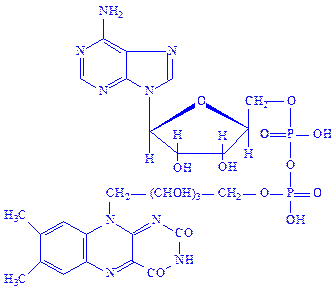
ФМН і ФАД – простетичні групи флавінових ферментів, або флавопротеїдів. Зокрема, ФМН як простетична група, з’єднуючись з апоферментом, утворює холофермент – „жовтий дихальний фермент” (ЖДФ):
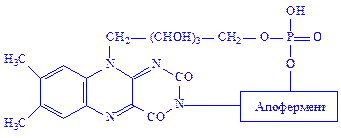
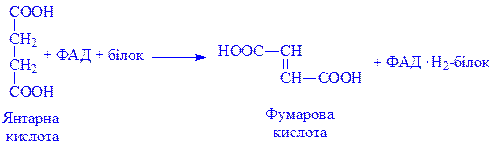
Ізоалоксазонове угрупування простетичної групи дає можливість ЖДФ виконувати найважливіші каталітичні функції, зокрема, брати участь в реакціях біологічного окислення. ЖДФ є переносником протонів і електронів в двох напрямах: у бік цитохромів або від цитохромів до піридиннуклеотидів дихального ланцюга і до окислених субстратів. Крім того, флавіннуклеотиди беруть участь у ряді інших реакцій обміну речовин. Серед них особливе місце займають реакції утворення подвійних зв’язків. Зокрема, сукцинатдегідрогеназа і ацил-КоА-дегідрогеназа циклу b-окислення жирних кислот каталізують процеси, пов’язані з утворенням подвійних зв’язків:
Тіамінфосфати. Тіамінфосфати є похідними вітаміну В1 або тіаміну. Простетичною групою ферментів найчастіше виступає тіамінпірофосфат (ТПФ). З’єднання тіамінфосфатів з апоферментами, мабуть, таке ж, як і флавіннуклеотидів. Каталітична активність ферменту пов’язана з іонізацією вуглецевого атома в положенні 2 тіазолового кільця, до яких і приєднується молекула субстрата:
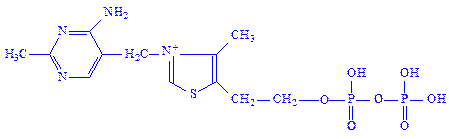
Під впливом позитивного заряду атома азоту від вуглецевого атома в положенні 2 відщеплюється протон, виникає негативно заряджений карбаніон. Карбаніон – нуклеофільний центр, який легко вступає в реакцію з субстратом, наприклад, з піровиноградною кислотою, утворюючи піруват-ТПФ-комплекс. Цей комплекс легко декарбоксилується, утворюючи альдегідо- або кето-ТПФ-комплекс, карбонільна група якого передається на відповідний акцептор, наприклад, на ліпоєву кислоту.
ТПФ після цього вступає в реакцію з новими порціями субстрата. ТПФ є простетичною групою не тільки піруватдекарбоксилази, але й інших ферментів, що беруть участь в обміні багатьох a-кетокислот, утворенні і розщепленні кетоцукрів, a-оксикетонів і дикетонів.
Піридоксальфосфат і піридоксамінфосфат – похідні вітаміну В6. Є складовою частиною піридоксалевих ферментів. Значення цих ферментів у білковому обміні велике, оскільки з їх діяльністю пов’язана більшість перетворень a-амінокислот: переамінування, декарбоксилування, рацемація, конденсація b- і g-заміщених a-амінокислот і т.д. Теорія каталітичної дії цих ферментів вперше була розроблена радянськими біохіміками О.E. Браунштейном і M.M. Шемякіним на прикладі реакцій переамінування:
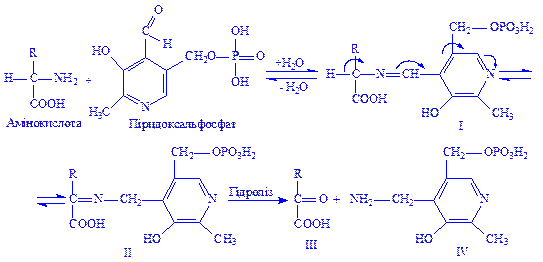
Ці реакції дають можливість організму отримати потрібні замінні амінокислоти для клітин і тканин. Крім того, окремі декарбоксилази, що містять в своїх молекулах піридоксальфосфат або піридоксамінфосфат, каталізують утворення в тканинах фізіологічно активних амінів: гістаміна з гістидина, серотоніна з триптофана та ін. З діяльністю піридоксалевих ферментів пов’язано утворення цистеїна з серина і гомоцистеїна, тирозина, триптофана.
Біотин. Приєднання біотина до апоферменту здійснюється за допомогою пептидного зв’язку, який утворюється за рахунок карбоксильної групи біотина і e-аміногрупи залишку лізину простого білка. Біотин входить до складу молекул багатьох ферментів, що каталізують реакції карбоксилування і перенесення карбоксильних груп.
Залізопорфіринові комплекси є простетичною групою каталази, пероксидази і цитохромів. У каталазі і пероксидазі, як і в гемоглобіні крові, простетична група – гем. Залежно від природи гема цитохроми ділять на чотири групи:
1. Цитохроми А – містять залізоформілпорфірин.
2. Цитохроми В – містять залізопротопорфірин.
3. Цитохроми С – містять заміщений залізомезопорфірин з ковалентними зв’язками між білком і порфірином.
4. Цитохроми D містять залізодигідропорфірин. Апоферменти – низькомолекулярні білки.
Кожна група цитохромів складається з індивідуальних представників. Вони позначаються малими латинськими буквами і цифровими підрядковими індексами: а, a1, а2, в, в1, в2 і т.д.
Зв’язок між апоферментом і простетичною групою найчастіше ковалентний і додатковий. Прикладом може бути цитохром с:
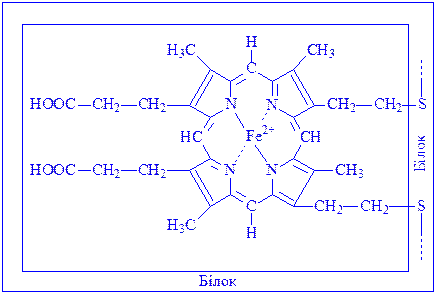
Цитохроми є складовою частиною дихального ланцюга. В ході функціонування якого електрони послідовно переносяться від „жовтого дихального ферменту” на цитохром b, c1, c, а і а3. Під впливом ферменту, цитохромоксидази цитохром а окислюється, електрон, що відщепився, переноситься на атом кисню, який іонізується і реагує з іоном водню. Утворюється вода. Енергія акумулюється у вигляді АТФ.
 2015-06-26
2015-06-26 2671
2671