Ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное (переходное) состояние при данной температуре. Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне (рис. 5.3).
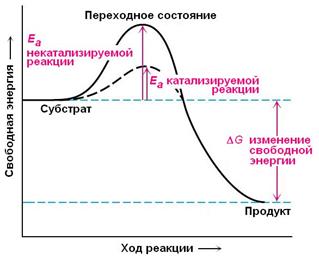
| Рис. 5.3. | Энергетические барьеры катализируемой и некатализируемой реакций. Следует отметить, что как катализируемая ферментом, так и некатализируемая реакция независимо от ее пути имеет одинаковую величину стандартного изменения свободной энергии. Действуя на скорость реакции, ферменты не изменяют равновесия между прямой и обратной реакциями, как и не влияют на величину свободной энергии реакции; они лишь ускоряют наступление равновесия химической реакции. Еа – энергия активации. |
Фермент, соединяясь с субстратом, образует короткоживущий фермент-субстратный комплекс, которому соответствует более низкая энергия активация по сравнению с субстратом в некатализируемой реакции. По завершении реакции фермент-субстратный комплекс распадается на продукт (или продукты) и свободный фермент.
 2015-06-26
2015-06-26 3015
3015
