Участок молекулы фермента, который предназначен для специфического связывания субстрата, называется активным центром. Активный центр – это уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное его взаимодействие с молекулой субстрата и принимающая прямое участие в акте катализа. У сложных ферментов в состав активного центра входит также кофактор.
В активном центре условно различают каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом и участок связывания, который обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. Несмотря на огромное разнообразие структуры ферментов, их специфичности и механизма действия, существует ряд общих закономерностей формирования активных центров:
1) на активный центр приходится относительно малая часть объёма фермента (5-10 аминокислотных остатков). Роль остальных аминокислот, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную конформацию для оптимального протекания химической реакции;
2) активный центр – это сложная трёхмерная структура, в образовании которой принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка (рис. 5.1). Поэтому при воздействии физических и химических факторов, вызывающих денатурацию (нагревание, концентрированные кислоты и щёлочи) утрачивается конформация активного центра и фермент теряет свою активность;
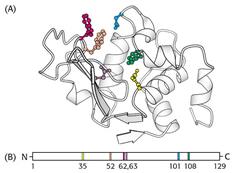
| Рис. 5.1. | Аминокислотные остатки, образующие активный центр лизоцима (А) принимают участие во взаимодействии с субстратом. Схематическое представление первичной структуры лизоцима показывает, что активный центр фермента построен из аминокислотных остатков, которые в полипептидной цепи расположены далеко друг от друга (В). |
3) активный центр имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата и катализа;
4) в составе активного центра можно условно выделить две части: а) контактный или якорный участок, где происходит связывание субстрата в нужной ориентации; б) каталитический участок, обеспечивающий протекание реакции. Четкую грань между каталитическим и субстратным центром провести можно не всегда – у некоторых ферментов они совпадают или перекрываются (рис. 5.2).
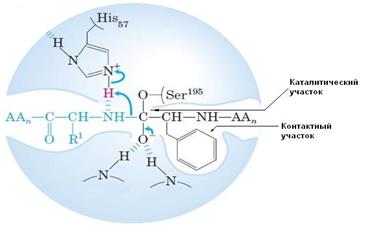
| Рис. 5.2. | Структура активного центра химотрипсина. Показаны принципиально важные для катализа остатки Ser195 и His 57. |
5) размеры ферментов намного превышают размеры их низкомолекулярных субстратов;
6) субстраты относительно слабо связываются с ферментами.
В связывании и превращении субстрата принимают участие следующие группировки аминокислотных радикалов:
- полярные заряженные: карбоксильные группы глутамата и аспартата, аминогруппы лизина; гуанидиновые группы аргинина; имидазольные группы гистидина;
- полярные незаряженные: гидроксильные группы серина и треонина; сульфгидрильные группы цистеина; фенольные группы тирозина;
- неполярные группы: углеводородные цепи алифатических аминокислот; ароматические кольца фенилаланина и триптофана.
У сложных ферментов в формировании активных центров принимают участие также функциональные группы коферментов.
В образовании фермент-субстратных комплексов принимают участие такие же взаимодействия, как и те, что обеспечивают формирование пространственной структуры макромолекул, межклеточных контактов и других процессов в биологических системах:
- водородные связи между полярными незаряженными группировками субстрата и фермента;
- ионные связи между противоположно заряженными группировками субстрата и фермента;
- гидрофобные взаимодействия между неполярными группировками субстрата и фермента.
Эти три основных типа нековалентных взаимодействий различаются по своей геометрии, энергии, специфичности.
 2015-06-26
2015-06-26 12368
12368
